[注:本站登载的某些文章并不代表本站支持或反对其观点或肯定其真实性]
| 警惕ADE:它有可能是新冠病毒的另一个杀手锏
奇点网 2020-04-23
新冠肺炎的临床和流行病学特征,给人类留下了一个又一个的谜团。
为什么有些患者开始症状轻,然后病情突然加重?
为什么有些感染者产生抗体的速度快,数量多,最后还是因感染而死去?
为什么纽约会有很多年轻人,没有什么基础疾病,却在很短时间内病情急剧恶化,最后进了ICU?
……
这些现象的幕后真凶之一,有可能就是让很多专家感到担忧的ADE效应。
什么是ADE
ADE的英文全称是Antibody Dependent Enhancement,翻译成中文就是:抗体依赖性增强。
这是什么意思呢?
在一般情况下,人体在感染病毒之后,会产生抵抗病毒入侵的抗体;不过,让人困惑的是,在一些情况下,这些抗体不仅不会消灭病毒,反而在与病毒结合之后增强病毒的感染能力,甚至是让病毒感染一些仅靠病毒自身不能感染的细胞。
一言以蔽之:抗体成了病毒进入细胞的帮凶!
怎么样,ADE效应是不是很迷。
从文献资料来看,最早关于ADE的描述出现在1964年[1]。当时科学家在研究抗虫媒病毒抗体对病毒的中和作用,结果却意外发现黄病毒科的抗病毒血清,居然增强了病毒的感染能力。
很显然,这与一直以来科学家对抗体的理解是相矛盾的。
这个现象曾一度困扰科学家近10年的时间,直到1973年科学家在ADE与登革热的流行病学和发病机制之间建立联系[2,3]。

▲登革热病毒(图源:Clinical OMICs)
研究人员注意到,有些人初次感染登革热病毒之后,症状轻微,甚至没有症状。奇怪的是,当这些患者过一段时间第二次感染登革热病毒时,他们不仅对这些病毒没有抵抗力,病情反而比第一次更重。这就是ADE效应在登革热患者身上的表现。
现在我们已经知道,登革热病毒实际上有4个亚型,每个亚型感染人体之后产生的抗体存在差异,因此人体免疫系统对不同亚型登革热病毒的免疫记忆也不相同。如果两次感染的登革热病毒不相同,那么上一次免疫记忆产生的抗体,就不能特异性结合第二次感染的病毒。
这就导致病毒不仅没有被清除,反而会让病毒在非特异性抗体的带领下,感染更多类型的细胞,表现在患者身上就是病情比第一次严重。
从此以后,科学家不仅发现许多病毒在感染细胞时存在ADE效应,而且还发现ADE的背后存在多种让人瞠目结舌的复杂作用机制。
揭秘ADE的机制
文章看到此处,我想你们最想知道的一个问题应该是:抗体究竟是如何把病毒带进细胞的?
一般而言,病毒进入人体细胞,依赖于病毒表面的特定蛋白与人体细胞表面的受体结合。拿新冠病毒来讲,那就是病毒的S蛋白与人细胞的ACE2受体结合。显然,对于那些不表达ACE2的免疫细胞等其他类型的细胞,新冠病毒按理说是不能感染的。
那对抗病毒的IgG抗体究竟是如何帮助病毒进入细胞的呢?
这要从IgG抗体的结构说起。
在IgG抗体中有个区域叫Fc段,它是IgG抗体与效应分子或者细胞相互作用的部位。Fc段有个受体叫FcR,这个FcR在很多组织细胞和免疫细胞表面有表达[4]。

▲抗体的结构(图源:wiki)
对,有很多研究都表明正是FcR帮助抗体和病毒组成的复合体更高效进了靶细胞[5]。甚至有研究表明,FcR能帮助某些病毒进入不表达病毒结合受体的细胞[6]。
那这么看来病毒感染后出现ADE效应是必然的了?
并不是这样。是否出现ADE效应还与抗体类型、浓度、构象和特异性等多个因素有关,以及与病毒的种类和剂量等有关[6]。可以说是相当地复杂。
在这篇文章里,我们主要围绕抗体自身展开。
通常情况下,人体感染病毒之后,并不是立即产生中和效果最好的抗体,而是会产生海量的多种多样的抗体。这些抗体里面有中和抗体,也有非中和抗体。

▲FcR与抗体和病毒的复合体结合(图源:wiki)
如果患者体内的中和抗体水平非常高,足以与病毒的关键蛋白充分结合,那么中和抗体不仅可以阻断病毒感染细胞,还可以借助于Fc段募集其他因子,破坏病毒的包膜等结构,达到溶解病毒的目的。在这种情况下,不会出现ADE效应。
言外之意,如果中和抗体的浓度不够高,以至于不能与病毒表面的关键蛋白充分结合,也就是科学家口中的亚中和浓度,中和抗体也有可能介导ADE效应。
如果患者感染病毒之后产生的抗体不能特异性结合病毒的关键蛋白,它们就不具备中和抗体的作用,它们更有可能与FcR结合,促进病毒与细胞的结合和进入,最终引发ADE效应。这也就是感染登革热病毒会出现ADE效应的关键所在。
ADE效应的手段远不止增强病毒的感染能力,它还会抑制细胞或者人体的免疫反应。
科学家在研究登革热病毒诱发的ADE效应时发现[7],通过FcR,登革热病毒和抗体的复合体可以进入免疫细胞,并阻断免疫细胞对病毒复制的抑制,让登革热病毒的增殖速度更快,最终导致免疫细胞死亡。

▲登革热的正常感染(左)和ADE效应(右)[7]
其他科学家在罗斯河病毒感染巨噬细胞的研究中也发现,通过FcR途径进入巨噬细胞的病毒,会抑制巨噬细胞表达抗病毒基因[8],抑制巨噬细胞的抗病毒活性。
以上就是ADE效应的部分机制。
实际上,ADE效应的机制远比上述介绍的内容复杂的多,不仅涉及到抗体,还与补体有关,还有很多未知。而且不同的病毒诱发ADE效应的机制可以完全不同,甚至同一个病毒也可以通过多种方式诱发ADE效应。
总的来说,在探索ADE效应这条路上,科学家还有很多事情要做。
新冠病毒感染会导致ADE效应吗?
至于新冠病毒感染会不会导致ADE效应,目前的答案是不知道。
毕竟没有直接的证据表明新冠病毒感染会出现ADE。
但这并不意味着我们就可以掉以轻心。
因为有间接的临床证据表明,新冠病毒感染可能存在ADE。
本月初,南开大学的曹雪涛教授发表了一篇重要的综述文章[9],系统阐述了新冠病毒产生的免疫学反应。他分析了两项新冠肺炎临床研究的数据,发现患有严重疾病的患者常常具有更高的IgG反应和更高的总抗体滴度,这两个指标也是与更差的预后相关[10,11]。他认为,这暗示了新冠病毒感染可能存在ADE。
▲新冠病毒(来自NIAID-RML)
同样是在本月初,美国长岛北岸医院ICU主任周秋萍透露[13],“纽约的ICU里有很多20岁到60岁之间的年轻人,这些年轻人没有什么基础疾病。很多年轻人都是走进急诊室的,大概在12到24小时之内病情急剧恶化,很多病人马上就要上有创通气,上呼吸机,而且在随后24小时之内,随着病情的变化,他们会发生多器官功能障碍。”
香港大学微生物学系终身教授、艾滋病研究所所长陈志伟在接受《南方人物周刊》采访的时候表示[14],“有些病人进来时看着很轻,过了一些天突然就变得非常严重。我们怀疑病症加重是否与产生了ADE抗体有关。”
加拿大圭尔夫大学的Jason A.Tetro也认为,世界其他地方新冠肺炎病例特征与中国武汉患者之间的差异,一个可能的原因是之前感染的冠状病毒,让新冠病毒感染者出现了ADE[15]。
除了上面的临床证据之外,还有来自其他冠状病毒的研究成果支撑。
就在今年2月份,美国明尼苏达大学的华人科学家团队就揭示了MERS-CoV引发ADE的分子机制[16]。他们发现,MERS-CoV受体结合域(RBD)的中和抗体会结合到病毒表面S蛋白上,改变S蛋白的构象,使S蛋白更容易被水解。于此同时,中和抗体的Fc段与细胞表面的FcR结合,通过规范的病毒受体依赖性途径引导病毒进入细胞。

▲新冠病毒(黄色)与死亡的细胞(图源:NIAID-RML)
很显然,MERS-CoV引起ADE的机制与登革热病毒不相同。MERS-CoV不需要第二次不同病毒的感染,直接就可以利用宿主的中和抗体,更高效地进入细胞。
与新冠病毒亲缘关系更近,且都依赖ACE2进入人体细胞的SARS-CoV也存在类似的现象。
2019年初,陈志伟教授团队发现,S蛋白的中和抗体在与SARS-CoV结合之后,会帮助SARS-CoV进入原本不表达ACE2的巨噬细胞,使得原本起修复作用的巨噬细胞变成了促进炎症的巨噬细胞,导致炎症加重,肺损伤加剧[17]。
实际上,新冠病毒可能也用同样的机制感染了患者的免疫细胞。因为已经有临床研究发现,新冠肺炎患者会出现外周淋巴细胞计数持续且显著减低的现象[18]。
已经有科学家猜测,新冠病毒可直接感染淋巴细胞,并启动或促进细胞淋巴细胞死亡[19]。由于淋巴细胞基本不表达ACE2,这表明新冠病毒感染免疫细胞存在另一种机制。这会不会是ADE效应导致的呢?
我们不难发现,SARS-CoV和MERS-CoV引起ADE的机制非常类似,而与登革热截然不同。以上研究均暗示,在冠状病毒第一次感染人体之后,就有可能出现ADE,导致患者的病情加重。
当然,新冠病毒会不会引起ADE,仍有待科学家进一步去证实。
如何避免ADE效应
如果在后续的研究中,科学家证实新冠病毒感染存在ADE效应的话,那么新冠肺炎的治疗策略和疫苗的研发策略都要做相应的调整。
对于治疗方式而言,我们不能仅仅盯着新冠病毒的那几个关键蛋白,还得考虑免疫系统产生的抗体与新冠病毒的协同作用。具体而言,就是还得盯着人体细胞的FcR。
好在已经有科学家在SARS-CoV感染中研究了这个问题,他们发现,只要用药物阻断FcR与抗体Fc段的结合,就可以降低ADE效应[17]。实际上,目前已经有很多靶向FcR的药物正在研发中[20]。
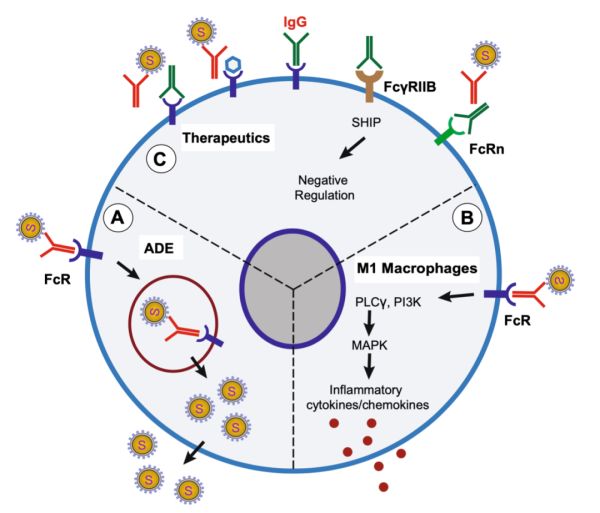
▲新冠病毒的ADE效应(A和B),以及消除ADE效应的策略(C)[20]
从疫苗开发的角度来讲,要避免ADE效应的出现,一个有效的办法就诱导细胞免疫,而不是以抗体为主的体液免疫,这样就可以避免ADE效应的出现[5]。
有研究表明,质粒DNA和病毒载体疫苗,以及减毒活疫苗,可以诱导强烈的细胞免疫,而不是产生抗体的体液免疫。
就在前几天,中国科学家团队发布了全球首个新冠疫苗的临床前数据[21]。从公布的数据来看,我国科学家开发的灭活新冠肺炎疫苗没有在实验动物身上诱发ADE效应。
总的来说,目前还没有直接的证据表明新冠肺炎存在ADE效应;但是临床的种种现象,以及其他冠状病毒的研究成果都表明,新冠肺炎极有可能存在ADE效应。
无论如何我们不能掉以轻心。
参考资料:
[1].Hawkes R A. ENHANCEMENT OF THE INFECTIVITY OF ARBOVIRUSES BY SPECIFIC ANTISERA PRODUCED IN DOMESTIC FOWLS[J]. Immunology and Cell Biology, 1964, 42(4): 465-482.
[2].Halstead S B, Shotwell H, Casals J, et al. Studies on the Pathogenesis of Dengue Infection in Monkeys. II. Clinical Laboratory Responses to Heterologous Infection[J]. The Journal of Infectious Diseases, 1973, 128(1): 15-22.
[3].Halstead S B, Orourke E J. Antibody-enhanced dengue virus infection in primate leukocytes[J]. Nature, 1977, 265(5596): 739-741.
[4].Yu Z, Lennon V A. Mechanism of Intravenous Immune Globulin Therapy in Antibody-Mediated Autoimmune Diseases[J]. The New England Journal of Medicine, 1999, 340(3): 227-228.
[5].Takada A, Kawaoka Y. Antibody‐dependent enhancement of viral infection: molecular mechanisms and in vivo implications[J]. Reviews in Medical Virology, 2003, 13(6): 387-398.
[6].Taylor A, Foo S, Bruzzone R, et al. Fc receptors in antibody‐dependent enhancement of viral infections[J]. Immunological Reviews, 2015, 268(1): 340-364.
[7].Halstead S B, Mahalingam S, Marovich M, et al. Intrinsic antibody-dependent enhancement of microbial infection in macrophages: disease regulation by immune complexes[J]. Lancet Infectious Diseases, 2010, 10(10): 712-722.
[8].Lidbury B A, Mahalingam S. Specific Ablation of Antiviral Gene Expression in Macrophages by Antibody-Dependent Enhancement of Ross River Virus Infection[J]. Journal of Virology, 2000, 74(18): 8376-8381.
[9].Cao X. COVID-19: immunopathology and its implications for therapy[J]. Nature Reviews Immunology, 2020: 1-2.
[10].Zhang B, Zhou X, Zhu C, et al. Immune phenotyping based on neutrophil-to-lymphocyte ratio and IgG predicts disease severity and outcome for patients with COVID-19[J]. medRxiv, 2020.
[11].Zhao J, Yuan Q, Wang H, et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019[J]. Clinical Infectious Diseases, 2020.
[13].https://www.thepaper.cn/newsDetail_forward_6798522
[15].Tetro J A. Is COVID-19 receiving ADE from other coronaviruses?[J]. Microbes and Infection, 2020, 22(2): 72-73.
[16].Wan Y, Shang J, Sun S, et al. Molecular mechanism for antibody-dependent enhancement of coronavirus entry[J]. Journal of Virology, 2019, 94(5).
[17].Liu L, Wei Q, Lin Q, et al. Anti–spike IgG causes severe acute lung injury by skewing macrophage responses during acute SARS-CoV infection[J]. JCI insight, 2019, 4(4).
[18].Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study[J]. The Lancet, 2020.
[19].Li H, Liu L, Zhang D, et al. SARS-CoV-2 and viral sepsis: observations and hypotheses[J]. The Lancet, 2020.
[20].Fu Y, Cheng Y, Wu Y. Understanding SARS-CoV-2-mediated inflammatory responses: from mechanisms to potential therapeutic tools[J]. Virologica Sinica, 2020: 1-6.
[21].Gao Q, Bao L, Mao H, et al. Rapid development of an inactivated vaccine for SARS-CoV-2[J]. bioRxiv, 2020.
|
|