第三章 精细有机合成的工艺学基础
3.1 概 述
精细有机合成的工艺学主要包括以下内容:对具体产品选择和确定在技术上和经济上最合理的合成路线和工艺路线;对单元反应确定最佳工艺条件、合成技术和完成反应的方法,以得到高质量、高收率的产品。
所谓合成路线,指的是选用什么原料,经由哪几步单元反应来制备目的产品。例如,在1.6中提到,苯酚的生产可以有好几条合成路线,它们各有忧缺点。关于合成路线将结合具体产品在各单元反应中讨论。
所谓工艺路线,指的是对原料的预处理(提纯、粉碎、干燥、熔化、溶解、蒸发、汽化、加热、冷却等)和反应物的后处理(蒸馏、精馏、吸收、吸附、萃取、结晶、冷凝、过滤、干燥等)应采用哪些化工过程(单元操作)、什么设备和什么生产流程等。
所谓反应条件指的是:反应物的分子比、主要反应物的转化率(反应深度)、反应物的浓度、反应过程的温度、时间和压力以及反应剂,辅助反应剂、催化剂和溶剂的使用和选择等。
所谓合成技术主要指的是:非均相接触催化、相转移催化、均相络合催化、光有机合成和电解有机合成以及酶催化等。
所谓完成反应的方法主要指的是:间歇操作和连续操作的选择,反应器的选择和设计等。为了完成化工生产,我们必须对所涉及的物料的性质有充分了解。各种物料的重要性质主要有:
(1)物料在一定条件下的化学稳定性、热稳定性、光稳定性以及贮存稳定性(包括与空气和水分长期接触的稳定性)等。
(2)熔点(凝固点)、沸点、在不同温度下的蒸汽压;物料在水中的溶解度、水在液态物料中的溶解度;物料与水是否形成恒沸物,以及恒沸温度和恒沸物组成等。
(3)比重、折光率、比热、导热系数、蒸发热、挥发性和粘度等。
(4)闪点、爆炸极限和必要的安全措施。
(5)毒性、对人体的危害,在空气中的允许浓度、必要的防护措施以及中毒的急救措施。
(6)物料的商品规格、各种杂质和添加剂的允许含量、价格、供应来源、包装和储运要求等。
以上性质可以查阅各种有关子册。
3.2.1 反应物的摩尔比
反应物的摩尔比指的是加入反应器中的几种反应物之间的摩尔数之比。这个摩尔比可以和化学反应式的摩尔数之比相同,即相当于化学计量比。但是对于大多数有机反应来说,投料的各种反应物的摩尔比并不等于化学计量比。
3.2.2 限制反应物和过量反应物
化学反应物不按化学计量比投料时,其中以最小化学计量数存在的反应物叫做“限制反应物”。而某种反应物的量超过限制反应物完全反应的理论量,则该反应物称为“过量反应物”。
3.2.3 过量百分数
过量反应物超过限制反应物所需理论量部分占所需理论量的百分数叫做“过量百分数”。若以Ne表示过量反应物的摩尔数,Ni表示它与限制反应物完全反应所消耗的摩尔数,则过量百分数为:
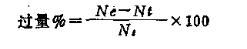
3.2.4 转化率(以x表示)
某一种反应物A反应掉的占其向反应器中输入量的百分数叫作反应物A的转化率。
3.2.5 选择性(以s表示)
选择性指的是某一反应物转变成目的产物理论消耗的摩尔数占该反应物在反应中实际消耗掉的总摩尔数的百分数。设反应物A生成目的产物P,Np表示生成目的产物的摩尔数,a,p分别为反应物A和目的产物P的化学计量系效,则选择性为:
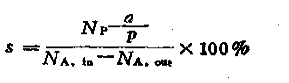
3.2.6 理论收率(以y表示)
收率指的是生成的目的产物的摩尔数占输入的反应物理摩尔数的百分数。这个收率又叫做理论收率。
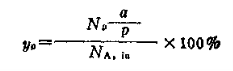
转化率、选择性和理论收率三者之间的关系是:y=s·x。
3.3 化学反应器
3.3.1 概述
化学反应器是反应原料在其中进行化学反应,生成目的产物的设备。化学反应器在结构上和材料上必须满足以下要求:
(1) 对反应物料(特别是非均相的气液反应物、液液反应物、气固反应物、液固反应物、气液固三相反应物)提供良好的传质条件,便于控制反应物系的浓度分步,以利于目的反应的顺利进行。
(2) 对反应物料(特别是强烈放热或强烈吸热的反应物系)提供良好的传热条件,便于热效应的移除或供给,以利于反应物系的温度控制。
(3)在反应的温度、压力和介质条件下,具有良好的机械强度和耐腐蚀性能。
(4) 能适应反应器的操作方式(间歇操作或连续操作)。
3.3.2 间歇操作和连续操作
在反应器中实现一个化学反应可以有两种操作方式,即间歇操作和连续操作。间歇操作是将各种反应原料按一定的顺序加到反应器中,并在一定的温度、压力下经过一定时间完成特定的反应,然后将反应好的物料从反应器中放出。因为反应原料是分批加到反应器中的,所以又叫做“分批操作”。在间歇操作时,反应物的组成随时间而改变。另外,反应物的温度和压力也可以随时间而改变。连续操作是将各种反应原料按一定的比例和恒定的速度连续不断地加入到反应器中,并且从反应器中以恒定的速度连续不断地排出反应产物。在正常操作下,反应器中某一特定部位的反应物料的组成、温度和压力原则上是恒定的。
连续操作比间歇操作有许多优点。第一,连续操作比较容易实现高度自动控制,产品质量稳定;而间歇操作的程序自动控制则相当困难而且费用昂贵,因此间歇操作比连续操作需要较多的劳动,而且反应的效果常常受人的因素影响。第二,连续操作很容易实现缩短反应时间。而间歇操作则需要有加料,调整操作的温度和压力,放料,以及准备下一批投料等辅助操作时间。因此,对于生产规模大、反应时间短的化学过程都尽可能采用连续操作。特别是气相反应和气固相接触催化反应则必须采用连续操作。第三,连续操作容易实现节能。例如从反应器中移出的热量以及热的反应产物在冷却时通过热交换器传出的热量可以用来预热冷的反应原料,或者把热量传递给水以产生水蒸汽。而要把间歇操作组合到节能系统中一般是难于实现的。
但是,间歇操作也有它独特的优点。第一,连续操作的技术开发比间歇操作困难得多。节能和节省劳动力一般是与生产规模成正比例的,对于小规模生产来说,开发一个连续操作常常是不值得的。第二,间歇操作的开工和停工一般比连续操作容易,间歇操作的设备在产量的大小上有较多的伸缩余地,更换产品也有灵活性,而连续操作的设备通常只能生产单一产品。第三,在某些情况下,由于反应原料或产物的物理性质(例如粘稠度和分散状态),或是由于反应条件的控制(例如温度、压力和操作步骤)等因素,难于采用连续操作。例如用固相法生产2,3-酸就必须采用间歇操作。因此,对于多品种、产量小的精细化工产品来说,间歇操作有相当广泛的应用。
3.3.3 间歇操作反应器
液液相或液固相间歇操作的反应器基本上和实验宝的设备相似,所不同的是规模大,制造材料相传热方式不同。这种间歇操作反应器可以是敞口的反应槽(相当于烧杯),也可以是带回流冷凝器的反应锅(相当于四口烧瓶),或者是耐压的高压釜。对于某些物料非常粘稠的液固相反应,则常常采用卧式转筒球磨机式反应器(固相罐)。最常用的传热方式是在锅外安装夹套或在锅内安装蛇形盘管。冷却一般用冷水或冷冻盐水。加热一般用水蒸汽,需要较高温度时(130~260℃)则用耐高温导热油。对于转筒球磨机式反应器(例如苯胺固相焙烘磺化制对氨基苯磺酸,料温约200℃)或其他高温反应过程(例如2-萘磺酸钠的碱熔制2-萘酚,料温28~320℃),还可以采用直接火加热(燃烧煤气、燃料油或煤)或者直接用电热。在个别情况下,也可以直接向反应器中加入碎冰进行冷却(例如重氮化和偶合反应),或者直接通入水蒸汽进行加热(例如某些萘系磺酸的水解反应)。
3.3.4 液相连续反应器
在连续操作的反应器中,有两种极限的流动模型,即“理想混合型”和“理想置换型”。
3.3.4.1 理想混合型反应器
它通常是装有搅拌器和传热装置的反应锅,如图所示。
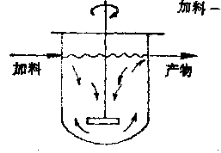
反应原料连续不断地加入到锅中,在搅拌下在锅内停留一定时间,同时反应产物也连续不断地从锅中流出。这种反应器的特点是:强烈的搅拌产生了反向混合作用(简称返混),即新加入的物料与已存在锅内的物料能瞬间完全混合,所以锅内各处物料的组成和温度都相同,并且等于出口处物料的组成和温度。但是,物料中各个粒子在反应器内的停留时间则并不相同。
锅式连续反应器的主要优点是强烈的搅拌有利于非均相反应物的传质,可加快反应速度。另外,也有利于强烈放热反应的传热,可加大反应锅的生产能力。例如,苯、甲苯和氯苯的一硝化都采用锅式连续反应器。
锅式连续操作也有很多缺点。第一,锅内物料的组成等于出口物料的组成,即其中反应原料的浓度相当低,这就显著影响反应速度。第二,流出的反应产物中也势必残留有一定数量未反应的原料从而影响收率。第三,锅内已经生成的反应产物的浓度相当高,它容易进一步发生连串副反应。例如,苯用混酸的一硝化过程,如果采用单锅连续操作,不仅设备生产能力低,反应产物中含有较多未反应的苯和硝酸,最不利的是产品硝基苯中含有高达2~4%的副产物二硝基苯。因此,单锅连续操作在工业上很少采用。
为了克服这个缺点,一般都采用多锅串联联法,如图所示。
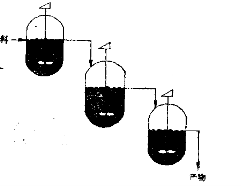
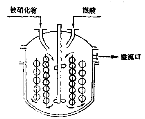
反应原料连续的加到第一个反应锅中,反应物料依次地连续流经第二个(和第三个)反应锅。而反应产物则从最后一个反应锅流出。多锅串联连续操作的特点是:几个反应锅之间并元返混作用,从而大大降低了返混作用的不利影响。因此它具有以下优点:第一个反应锅中反应原料的浓度比较高,反应速度相当快,可大大提高设备的生产能力;每个反应用可以控制不同的反应温度;另外,在最后一个反应锅中,反应原料的浓度已经变得很低,并大大减少反应产物中剩余未反应物的含量,有利于降低原料的消耗定额,并大大减少连串反应副产物的生产量。为了避免原料以短路的方式从各反应锅中流出,可以在锅内安装导流筒,或是将传热蛇管做成导流简的形式,如图所示。
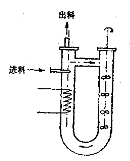
另外也可以把反应器做成U形循环管的形式,如图所示。
3.3.5 气液相反应器
气液相反应主要是利用空气中氧的氧化反应,利用氯气的氯化反应以及用氢气的加氢反应等。大规模生产,一船都采用鼓泡塔式反应器。这类反应器既可以间歇操作,也可以连续操作。在连续操作时,反应气体总是从塔的底部输入,尾气从塔的顶部排出。而液态物料即可以从塔的底部输入,从塔的上部流出(并流法),也可以从塔的上部输入,从塔的底部流出(逆流法),如图所示。

气液相塔式反应器
因为在塔中有一定的返向混合作用,为了减少它的不利影响,并使气液相之间有良好的传质作用,可在塔内装有填料、筛板、泡罩板、各种挡网或挡板等内部构件。为了控制反应温度,可采用内部热交换器或外循环式热交换器。为了避免塔身太高而增加通入气体的压头,也可以来用多塔串联的方式,从每个塔的底部通入反应气体。
当气液相反应速度相当快,热效应相当大时,也可以采用列管式并流反应器(例如高碳烷烃的氯化)或降膜逆流管式反应器(例如十二烷基苯磺化)。
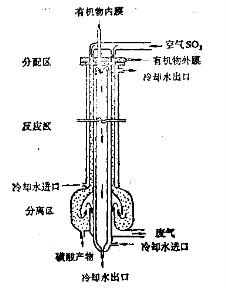
双膜反应器
3.3.6 气固相接触催化反应器
气固相接触催化反应是将反应原料的气态混合物在一定的温度、压力下通过固体催化剂而完成的。这类反应方式在工业上有广泛的应用,它一般都采用连续操作的方式。这类反应器设计的主要问题是传热和催化剂的装卸。这类反应器主要有三种类型,即绝热固定床反应器、列管团定床反应器和流化床反应器。
3.3.6.1 绝热固定床反应器
单层绝热固定床反应器的结构非常简单,如下图所示,它是一个没有传热装置,只装有固体催化剂的容器。反应原料从容器的一端输入,反应产物则从容器的另一端输出。这类反应器的主要优点是设备结构简单,空间利用率高、造价低、催化剂装卸容易。但是,在这类反应器中,反应物料和催化剂的温度是变化的。对于放热反应,从进口到出口温度逐渐升高。对于吸热反应,从进口到出口温度逐渐降低。而且反应过程的热效应越大,进出口的温差越大。由于这个特点使得单层绝热固定床反应器只适用于过程热效应不大、反应产物比较稳定、对反应温度变化不太敏感、反应气体温合物中含有大量惰性气体(例如水蒸汽或氮气),一次通过反应器转化率不太高的过程。例如,氯苯的气相水解制苯酚,甲醇的氧化脱氢制甲醛等,另外,单层绝热固定床反应器中的催化剂层不宜太厚,以免进口和出口的温差太大,因此,只适用于反应停留时间短的过程。

单层绝热反应器
当反应的热效应较大时,为了改善反应的温度条件并提高转化率,常常采用多段绝热反应器,如图所示。
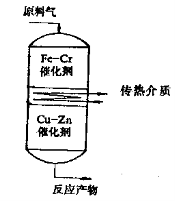
CO水蒸汽变换反应装置示意图
为了调整反应温度,可根据过程的特点,选择合适的载体或冷却剂;对于放热反应,可进行原料气的预热(例如,一氧化碳的水蒸汽转变制氢);对于吸热反应还可以采用外部管式加热炉。
3.3.6.2 列管式固定床反应器
列管式固定床反应器的结构类型很多,最简单的结构类似于单程列管式换热器,如图所示。
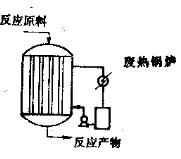
列管式固定床反应器
催化剂放在列管内,载热体在管外进行冷却或加热。对于放热反应,可以用熔盐或其它载热体将热效应移出。热的载热体经废热锅炉降温后再返回列管反应器,废热锅炉吸收热量后可产生0.6~2.0MPa的水蒸汽。熔盐是等分子比硝酸钾和亚硝酸钠的混合物,熔点141℃,可在147~540℃操作。它的优点是比热和导热系数大,传热效果好。对于吸热反应,根据所要求的温度,可以用液态或蒸汽态的载热体进行加热。另外也可以用电热或用外部管式炉加热(多段固定床反应器)。
3.3.6.3 流化床反应器
它的基本结构如图所示,主要构件是壳体、气体分布板、热交换器、催化剂回收装置。有时为了减少反向混合并改善流态化质量,还在催化剂床层内附加挡板或挡网等内部构件
流态化的基本原理是:当气体经过分布板以适当速度均匀地通过粉状催化剂床层时,催化剂的颗粒被吹动,漂浮在气体中做不规则的激烈运动,整个床层类似沸腾的液体一样,能够自由运动,所以又叫做沸腾床。
流化床的主要优点是:采用细颗粒催化剂有利于反应气体在催化剂微孔中的内扩散,催化剂表面的利用率高。加强床层的传热,床层温度均匀,可控制在1~3℃的温度差范围内。便于催化剂的再生和更换。制造费用比列管式固定床低得多。流化床反应器广泛用于空气氧化、催化裂化等反应过程。
流化床的主要缺点是,由于返混作用,对于某些反应转化率和选择性不如固定床;催化剂容易磨损流失;不能使用表面型颗粒状催化剂。
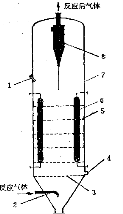
流化床反应器
1-加催化剂口,2-预分布器,3-分布板,4-卸催化剂口,
5-内部构件,6-热交换器,7-壳体,8-旋风分离器
3.4 精细有机合成中的溶剂效应
3.4.1 概述
3.4.1.1 溶剂对有机反应的影响
溶剂的作用不只是使反应物溶解,更重要的是溶剂可以和反应物发生各种相互作用。如果选择合适的溶剂就可以使主反应显著地加速,并且能有效地抑制副反应。另外,溶剂还和影响反应历程、反应方向相立体化学。因此,了解溶剂的性质、分类以及溶剂和溶质之间的相互作用,并合理地选择溶剂,对于目的反应的顺利完成有重要意义。
3.4.1.2 溶液和溶解作用
溶质溶解于溶剂而形成的均态混合物体系叫做溶液。溶解作用的最古老的经验规则是“相似相溶”。总的来说,一个溶质易溶于化学结构相似的溶剂,而不易溶于化学结构完全不同的溶剂。极性溶质易溶于极性溶剂,非极性溶质易溶于非极性溶剂。但是,也有一些例外,即化学结构相似的组分呈现不溶性,但化学结构不相似的组分却能互相溶解。一般认为与溶解作用有关的因素主要有:
(1)相同分子之间的引力与不同分子之间的引力的相互关系。
(2)由分子的极性所引起的缔合程度。
(3)溶剂化作用。
(4)溶剂和溶质的分子量。
(5)溶剂活性基团的种类和数目
3.4.1.3 溶剂和溶质之间的相互作用力
大量溶剂分子和少量溶质分子之间的相互作用力可以分为三大类:
(1)库仑力 即静电吸引力,它包括离子-离子力和离子-偶极力。
(2)范德华(Van der Waals)力 亦称内聚力,它包括偶极—偶极力(定向力)、偶极-诱导偶极力(诱导力)和瞬时偶极—诱导偶极力(色散力)。
(3)专一性力 它包括氢键缔合作用、电子对给体/电子对受体相互作用(电荷转移力)。溶剂化作用、离子化作用、离解作用和憎溶剂相互作用等。
第一类和第二类分子间力是普通存在的非专一性力。第三类分子间力是只有在一定结构之间才能发生的、有一定方向的专一性力。
3.4.2 溶剂的分类
溶剂的分类有许多方案,各有一定的用途。
3.4.2.1 溶剂按化学结构分类
溶剂按化学结构可以分为无机溶剂和有机溶剂两大类。常用的无机溶剂数量很少。把溶剂按化学结构分类,可以给出某些定性的预示。这就是前面提到的“相似相溶”原则。另外,根据各类溶剂化学反应性的知识,也可以帮助我们合理地选择溶剂,避免在溶质和溶剂之间发生不希望的副反应。
3.4.2.2 溶剂按偶极距μ和介电常数ε分类
偶极矩μ和介电常数ε是表示溶剂极性的两个重要参数,因此这种分类法具有重要实际意义。
1. 偶极矩μ
分子中具有永久偶极矩的溶剂叫做“极性”剂。反之,分子中没有永久偶极矩的溶剂则叫做“无极性”或“非极性”溶剂,例如己烷、环己烷、苯、四氯化碳和二硫化碳等。由于没有永久偶极短的溶剂是极少的,因此把偶极矩小于2.5D的非质子弱极性溶剂(例如氯苯和二氯乙烷)也列为非极性溶剂。
偶极矩主要影响在溶质(分子或离子)周围的溶剂分子的定向作用。
2. 介电常数ε
如果溶剂分子本身没有永久偶极矩,则外电场会使溶剂分子内部分离出电荷而产生诱导偶极。具有永久偶极或诱导偶极的溶剂分子被充电的电容器板强制地形成一个有序排列,从而引起所谓的“极化作用”。极化作用越大,电场强度的下降也越大,即E值越小,介电常数ε越大。因此,介电常数表示溶剂分子本身分离出电荷的能力,或溶剂使它的偶极定向的能力。
3. 溶剂极性的本质—溶剂化作用
关于溶剂的“极性”这个术语,直至现在尚未被确切地下定义。关于溶剂的所谓极性,重要的是它的总的溶剂化能力。溶剂化作用指的是每一个被溶解的分子(或离子)被一层或几层溶剂分子或松或紧地包围的现象。溶剂化作用是一种十分复杂的现象,它包括溶剂与溶质之间所有专一性和非专一性相互作用的总和。这样多的溶剂、溶质相互作用,很难用一个简单的物理量来表示。习惯上,常常用偶极矩或介电常数表示。但是这两个物理量都只能反映溶剂的一部分性质或起某种作用。尽管如此,把溶剂按照它们的极性(偶极矩或介电常数)分成几种不同的类型,并分别讨论各类溶剂对溶质分子(或离子)的作用,对于为各种具体反应选择合适的溶剂还是有重要实际意义的。
3.4. 3 有机反应中溶剂的使用和选择
3.4.3.1 有机反应对溶剂的要求
在有机反应中溶剂的使用和选样,除了考虑溶剂对主反应的速度、反应历程、反应方向、和立体化学的影响以外,还必须考虑以下因素:
(1) 溶剂对反应物和反应产物不发生化学反应,不影响催化剂的活性。溶剂本身在反应条件下及后处理条例下是稳定性。
(2) 溶剂对反应物有较好的溶解性,或者使反应物在溶剂中能良好分散.
(3) 溶剂容易从反应物中回收,损失少,不影响产品的质量。
(4) 对溶剂尽可能不需要太高的技术安全措施。
(5) 溶剂的毒性小,含溶剂的废水容易处理。
(6) 溶剂的价格便宜、供应方便。
3.4. 3.2 各类反应的适用溶剂
1. 硝化
混酸硝化:二氯甲烷、二氯乙烷;
稀硝酸硝化:氯苯、邻二氯苯;
均相硝化:浓硫酸、醋酸、过量浓硝酸;
2. 磺化
溶剂磺化:乙酸、三氯甲烷、四氯化碳
三氧化硫或氯磺酸磺化:1,2-二氯乙烷、1,1,1-三氯乙烷、邻二氯苯、三氯苯、硝基苯;
焙烘磺化:邻二氯苯、三氯苯
恒沸去水磺化:邻二氯苯、煤油
3. 卤化
非水介质:浓硫酸、氯磺酸、三氯化磷、三氯氧磷、四氯化钛、四氯化碳、二氯乙烷、氯苯、邻二氯苯、醋酸
水介质:氯苯、邻二氯苯、硝基苯等
4. 催化加氢
低碳醇、乙酸乙酯、乙酸、丙酮、水、二氧六环、烃类
5. 氧化
浓硫酸、乙酸、水、二氧六环、石油醚、硝基苯、吡啶
6. Friedel-Crafts反应
溶剂法:二氯乙烷、四氯乙烷、1,1,1-三氯乙烷、二硫化碳、石油醚、环丁砜、过量的液态反应组分
熔融法:ALCl3-NaCl、AlCl3-NaCl-H2NCONH2
3.5 气固相接触催化
3.5.1 概述
气固相接触催化反应是将气态反应物在一定的温度、压力下连续地通过固体催化剂的表面而完成的。这种反应方式可应用于许多单元反应。
固体催化剂通常是由主要催化活性物质、助催化剂和载体所组成。有时为了便于制成所需要的形状或改善催化剂的机械强度或孔隙结构,在制备催化剂时还加入成型剂或造孔物质。
固体催化剂按照粒度可以分为颗粒状和粉末状两种类型。颗粒状催化剂用于固定床反应器,粉末状催化剂用于流化床反应器。
固体催化剂按照表面积又可以分为高比表面型和低比表面型两类。催化剂的表面包括外表面和孔隙中的内表面两部分。每克催化剂的总表面积叫做比表面,它的单位是m2/g。
固体催化剂的密度(s/mL)用视比重来表示。它是把一定重量的催化剂放在量筒中,直接观测其体积而算得的。
关于固体催化剂的作用,虽然已经提出不少催化理论,但是还没有一个理论能全面地、完善地解释所有各种接触催化反应的机理。最常用的理论是活性中心理论、活化组合物学说和多位(活化络合物)学说等。这些学说的要点是催化剂的表面只有一小部分特定的部位能起催化作用,这些部位叫做活性中心。反应物分子的特定基团在活性中心发生化学吸附,形成活化络合物。然后活化络合物再与另一个或另一种未被吸附的反应物分子相作用,生成目的产物。或者是两种反应物分子分别被两个相邻的不同的活性中心所吸附分别生成活化络合物,然后两个活化络合物相互作用而生成目的产物。由于活性中心的特殊性,所以一种优良的催化剂可以只对某一类甚至某一个具体反应具有良好的催化作用,即对目的反应具有良好的选择性。
3.5.2 催化剂的选择性、活性和寿命
3.5.2.1 催化剂的选择性
它指的是特定催化剂专门对某一化学反应起加速作用的性能。其选择性也是用某一反应物通过催化剂后转变为目的产物时理论消耗的摩尔数占该反应物在反应中实际消耗掉的总摩尔数百分数来表示,催化剂的选择性与催化剂的组成、制法和反应条件等因素有关。
3.5.2.2 催化剂的活性
在工业上,催化剂的活性通常用单位体积(或单位重量)催化剂在特定反应条件下,在单位时间内所得到的目的产物的重量来表示。对于某些催化反应,工业催化剂的活性还使用在特定的气体时空速度下,反应物的转化率或目的产物的收率来表示。
3.5.2.3 催化剂的寿命
它指的是催化剂在工业反应器中使用的总时间。催化剂在使用过程中,由于温度、压力、气氛、毒物的影响,以及焦油或积碳的生成等因索,都会或多或少地使催化剂发生某些物理的或化学的变化,例如熔结、粉化以及结晶结构或比表面的变化等,这些都会影响催化剂中的活性中心,从而影响催化剂的活性和选择性。当催化剂的活性和选择性下降到一定程度,并且不能设法恢复其活性时,就需要更换催化剂。工业催化剂的寿命与反应类型、催化剂的组成和制法等因素有关。有些催化剂的寿命可长达数年,有的催化剂寿命只有几小时。
催化剂使用一定时间后,因活性下降,需要活化再生,这个使用时间叫作催化剂的活化周期。
3.5.3 催化剂的组成
3.5.3.1 催化活性物质
它指的是对目的反应具有良好催化活性的成分。对于具体反应,其催化活性物质是通过大量实验筛选出来的。它通常是单一成分或二到三种成分。例如,对于强氧化反应的催化剂,其活性组分通常都是五氧化二钒。
3.5.3.2 助催化剂
它是本身没有催化活性或催化活性很小但是能提高催化活性物质的活性、选择性或稳定性的成分。在催化剂中通常都含有适量的助催化剂。助催化剂主要是在高温下稳定的各种金属氧化物、非金属氧化物、金属盐和金属元素。
3.5.3.3 载体
载体是催化活性组分和助催化剂的支持物、粘结物或分散体。由于使用载体、在催化剂中催化活性组分和助催化剂的含量可以很低。载体的机械作用是增加催化活性组分的比表面,抑制微晶增长,从而延长催化剂的寿命,使催化剂具有足够的空袭度、机械强度(硬度、耐磨性、耐压强度等)、热稳定性、比热和导热率等。另外,有些载体还常常与催化活性组分发生某种化学作用,改变了催化活性组分的化学组成和结构,从而改善了催化剂的活性和选择性。因此,在制备催化剂时载体的选择也是很重要的。
3.5.4 催化剂的毒物、中毒和再生
催化剂因微量外来物质的影响,使其活性和选择性下降的现象叫做催化剂的中毒。微量外来物质叫作催化剂的毒物。
3.5.4.1 催化剂的毒物
在工业生产中,催化剂的毒物通常来自反应原料。有时毒物也可能是在催化剂制备过程中混入的,或者是来自其它污染源。由于中毒作用通常发生在催化活性组分表面的活性中心上,所以微量毒物就能引起催化剂活性显著下降。
3.5. 4.2 催化剂的中毒
中毒是由于毒物与催化活性组分发生了某种作用,因而破坏或遮盖了活性中心所造成的。毒物在活性中心吸附较弱或化合较弱,可以用简单的方法使催化剂恢复活性的中毒现象叫作“可逆中毒”或“暂时中毒”。毒物与活性中心结合很强,不能用一般方法将毒物除去的中毒现象叫作“不可逆中毒”或“永久中毒”。催化剂暂时中毒,可设法再生。催化剂永久中毒后,就需要更换新鲜催化剂。
3.5.4.3 催化剂中毒的预防和再生
为了避免催化剂的中毒,一种新型催化剂在投入生产使用前,都应指出哪些是毒物,以及这些毒物在反应原料中的最高允许含量。当原料中有害物质的含量超过规定时,必须对原料进行精制,或换用其他原料。催化剂暂时中毒可设法再生。再生的方法通常是用空气、水蒸汽或氯气在一定温度下通过催化剂以除去积碳、焦油物或硫化氢等毒物。当催化剂活性下降很慢,使用较长时间才需要进行再生时,再生过程可以就在反应器中进行。
3.5.5 催化剂的制备
一种优良的催化剂一般应具备以下性能。
(1) 活性高、选择性好、对热和毒物稳定、使用寿命长、容易再生。
(2) 机械强度和导热性好。
(3) 具有合适的宏观结构。例如,比表面、孔隙度、孔径分布、颗粒度和微晶结构等。这种宏观结构既要提供足够的催化表面,又要能使反应物和产物在反应过程中顺利扩散。
(4)制备简便、价格便宜。
控制备催化剂时,常常使用一系列化学的、物理的和机械的专门处理。应该指出,一种催化剂尽管组分和含量完全相同,但是只要在处理细节上稍有差异,就可能因催化剂的微观结构不同,而导致其催化性能有很大的差异,甚致不符合使用要求。因此,催化剂的制备细节都是严格保密的。
3.6 相转移催化
3.6.1 概述
发生双分子反应的最起码条件是两个反应物分子之间必须发生碰撞。如果两个分子不能披此靠扰,那么不管其中一种分子的能量有多大,它也不能和另一种分子发生反应。例如,溴辛烷与氰化钠在一起共热两星期,也不发生反应。这是因为氰化钠完全不溶于溴辛烷的缘故。对于无机盐与有机物的反应,传统的解决办法是使用既具有亲油性,又具有亲水性的溶剂。例如,甲醇、乙醇、丙酮、二氧六环等。但是这也有一定的困难,即无机盐在这些溶剂中的溶解度很小,而有机物又常常难溶于水。后来发现非质子极性溶剂对无机盐有一定的溶解度,它能使二元盐中的阳离子专一性溶剂化,从而使阴离子成为高活性的裸阴离子,对于亲核取代反应是良好的溶剂。但是使用这类溶剂也有缺点。主要是价格贵、难于精制和干燥、不易长期保存在无水状态、有时少量水会对反应产生干扰、反应后难回收、有毒和操作不便。
为此,在60年代末又发展了一种“相转移催化”有机合成新方法。它的优点是:第一,可以不用上述特殊溶剂,并且常常不要求无水操作。第二,由于相转移催化剂(PTC)的存在,使需要参加反应的阴离子具有较高的反应活性,从而降低反应温度、缩短反应时间、简化工艺过程、提高产品的收率和质量、并减少三废。第三,具有通用性,可广泛应用于许多单元反应。相转移催化化的缺点是相转移催化剂价格较贵,只有在使用相转移催化法能显著提高收率、改善产品质量、取得较好经济效益时,才具有工业应用价值。尽管如此,它在工业上已取得许多有价值的成果。
3.6.2 相转移催化剂
相转移催化剂至少要能满足以下两个基本要求:一个是能将所需要的离子从水相或固相转移到有机相;另一个是要有利于该离子的迅速反应。
当然,一种具有工业使用价值的相转移催化剂还必须具备以下条件:
(1) 用量少,效率高,自身不会发生不可逆的反应而消耗掉,或者在过程中失去转移特定离子的能力。
(2) 制备不太困难,价格合理。
(3) 毒性小,可用于多种反应。
3.6.3 相转移催化的应用
根据相转移催化原理可以看出,凡是能与相转移催化剂形成可溶于有机相的离子对的多种类型化合物,均可采用相转移催化法进行反应。现在它己用于许多单元反应,实例很多。
3.6.5.1 二卤卡宾的产生和应用
二氯卡宾(∶CCl2)又名二氯碳烯或二氯亚甲基,它的碳原子周围只有六个电子,是一个非常活泼的缺电子试剂,容易发生各种加成反应。但二氯卡宾极易水解,在水中的生存期不到1秒。产生二氯卡宾的传统方法要求绝对无水和其他很不方便的条件。而在相转移催化剂的存在下,则可以由氯伤与氢氧化钠浓溶液相作用而产生稳定的二氯卡宾,其反应历程大致如下。
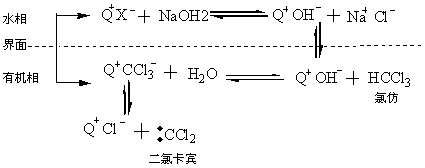
由氯仿生成二氯卡宾的反应历程
即在水相中季铵盐Q+Xˉ与NaOH作用,生成季铵碱离子对Q+OHˉ,它被萃取到有机相,与氯仿作用而生成二氯卡宾。在有机相中二氯卡宾水解很慢。因为有机相中二氯卡宾与三氯甲基季铵盐处于一个平衡体系中,如果二氯卡宾不发生进一步反应,它在有机相中仍能保持原有活性达数日之久。当有机相中存在有烯烃、芳环、碳环、醇、酚、醛、胺、酰胺等试剂时,就可以发生加成反应而生成多种类型的化合物。
3.6.5.2 O-烃化(醚类的合成)
对硝基苯乙醚是由对硝基氯苯与氢氧化钠的乙醇溶液相作用而制得的。其反应式如下:
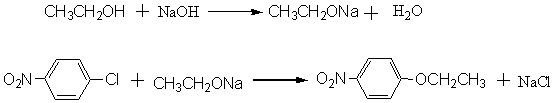 按老工艺不加相转移催化剂,O-芳基化反应(烷氧基化反应)要在压热釜中加热几十小时,对-硝基氯苯的转化率只有75%,要用减压蒸馏法回收未反应的对硝基氯苯,能耗大,另外,还有水解副反应,生成对-硝基酚钠,废液多。按消耗的对-硝基氯苯计,对-硝基苯乙醚的收率只有85~88%。
按老工艺不加相转移催化剂,O-芳基化反应(烷氧基化反应)要在压热釜中加热几十小时,对-硝基氯苯的转化率只有75%,要用减压蒸馏法回收未反应的对硝基氯苯,能耗大,另外,还有水解副反应,生成对-硝基酚钠,废液多。按消耗的对-硝基氯苯计,对-硝基苯乙醚的收率只有85~88%。
加入相转移催化剂,在常温、常压下只需几个小时,对-硝基氯苯的转化率即达到99%以上,对-硝基苯乙醚的收率可达92~94%,纯度达99%以上。显然,这是因为相转移催化剂季铵盐Q+X-将原来难溶于对-硝基氯苯的乙醇钠转变为易溶于对-硝基氯苯和对-硝基苯乙醚的Q+C2H5O-离子对的缘故。
3.6.5.3 O-酰基化反应(酯类的合成)
例如从二乙氧基硫代磷酰氯与对-硝基苯酚钠在甲苯-氢氧化钠水介质中制备乙基对硫磷(有机磷杀虫剂)时:
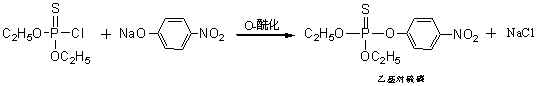
如果不加入相转移催化剂,反应速度很慢,而且有水解副反应。但是,只要加入很少量的三甲胺或季铵盐,在25~40℃反应1小时,对硫磷的收率可达95~99.5%。显然,在这里季铵盐Q+X-的作用是将不溶于甲苯的对硝基酚钠离子对转变成易溶于甲苯的Q+-OC6H4NO2离子对的缘故。
3.6.5.4 氰离子的亲核取代
例如,从对氯氯苄与氰化钠作用制备对氯苄氰(农药中间体)时由于采用相转移催化剂,可以不用非质子极性有机溶剂,并且可缩短反应时间,收率可达94~96%。
 3.6.6 液、固、液三相相转移催化
3.6.6 液、固、液三相相转移催化
考虑到相转移催化剂价格贵,难回收,又发展了固体相转移催化剂。它是将季铵盐、季鏻盐、冠醚或开链聚醚连接到聚合物上而得到的不溶于水和一般有机溶剂的固态相转移催化剂。相转移催化反应在水相、固体催化剂和有机相这三相之间进行。所以这类催化剂又叫做“三相催化剂”。它的优点是:操作简便、反应后容易分离,催化剂可定量回收。另外,这种方法所需费用和能源都很低,并适用于自动化连续生产。60年代这种催化剂已成功地用于合成氰醇、氰乙基化和安息香缩合等反应。已引起工业界的极大兴趣。另外,这种催化剂还可用于氨基酸立体异构体的分离,手征性冠醚聚合物催化剂适用于不对称合成。
3.7 均相络合催化
均相络合催化指的是用可溶性过渡金属络合物作为催化剂,在液相对有机反应进行均相催化的方法。这种方法在工业上有重要应用。1977年,美国利用均相络合催化大约生产了900万吨有机化学品,并相继建立了约24个重要工业过程。
3.7.1 过渡金属化学
3.7.1.1 过渡金属的特点
最常用的过渡金属主要有铜组的钛Ti、钒V、铬Cr、锰Mn、铁Fe、钴Co、镍Ni、铜Cu;银组的钼Mo、钌Ru、铹Rh、钯Pd、银Ag;金组的钨W、铱Ir、铂Pt等。典型的过渡金属原子都具有在几何形状上和能量特征上适于成键的1个s轨道、3个p轨道和5个d轨道。在特殊情况下,这9个轨道可以和9个配位体成键。例如,铼的络合物ReH7[P(C2H6)2(C6H5)]2,它具有7个Re-H共价键和两个Re-P配位键。在这里,铼原子一共和9个配位体成链。
3.7.1.2 18电子规则
如果过渡金属原子的9个可能成键的轨道都是充满的,即外层轨道上的总电子数是18,则表明这个络合物是饱和的,稳定的,它不能再与另外的配位体络合。这时配位体的取代反应要允许从18电子络合物上解离下来一个给电子配位体,生成一个16电子的“配位不饱和”型络合物,这种络合物可以再和其他配位体结合,又生成饱和的18电子络合物。这就是18电子规则。当然,在均相络合催化反应中,并不总是需要经过18电子络合物。
3.7.1.3 配位体
各种配位体与过渡金属原子的成键方式和给电子能力,一般确定如下:
单电子配位体:它提供一个电子与过渡金属原子形成共价键。例如,氢基、甲基、乙基、丙基和氯基等。
二电子配位体:它提供两个电子与过渡金属形成配位键。例如,一氧化碳(其中碳原子)、单烯烃(其中双键的两个π电子)、胺类(其中氮原子)、膦类(其中磷原子)和氰基(其中碳原子)等电子对给体,以及一价阴离子等。
三电子配位体:例如,π-1-甲基烯丙基(其中一对π电子和相邻碳原子上的一个电子)。
四电子配位体:例如,二烯烃(两个双键上的四个π电子)。
3.7.2 均相络合催化剂
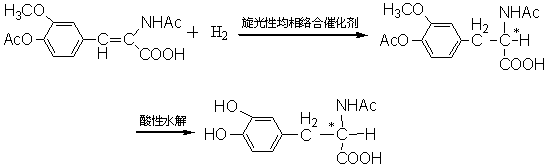
均相络合催化能够用于多种不同类型反应的奥秘就在于许多过渡金属原子能以不同的价态出现,并且能与多种不同的配位体以共价键或配位键两种不同的键型相结合而给出多种多样功能不同的催化剂。这类催化别是分子态的,它能与各种反应物分子发生特定的一系列基本反应,并通过催化循环而得到目的产物,并重新生成催化剂。对于不同的反应,其催化剂分子不仅需要特定的过渡金属原子,而且还需要结合特定的配位体,才能使催化剂具有高效率和商选择性。对于烯烃的加氢、加成、齐聚,以及一氧化碳的碳基合成等反应,所用的催化剂分子中一般要用软的或可极化的配位体来稳定过渡金属原子的低价络合物。这类配位体主要有:一氯化碳、胺类、膦类,较大的卤素阴离子和CN—阴离子等。软的配位体常常是通过σ-给体键和π-受体键的相互作用与金属原子结合的。例如,加氢所用的催化剂主要有:氯化三苯基膦,对于不对称加氢,还需要使用不对称的膦配位体。如:
3.7.3 均相络合催化的基本反应
在均相络合催化的反应历程中所发生的单元反应,都是配位化学和金属有机化学个的一些基本反应。将这些基本反应适当组合,组成催化循环,就得到目的产物,并重新生成催化剂。主要的基本反应有以下几种。
3.7.3.1 络合与解离
络合指的是一个配位体以简单的共价键或配位键与过渡金属原子结合而生成配位络合物的反应。它是均相络合催化中不可缺少的反应。例如,以含磷螯合配位体的氢化镍为催化剂(以M-H表示),在乙烯的齐聚制高碳α-烯烃时,其第一步基本反应就是乙烯与镍原子的配位络合。
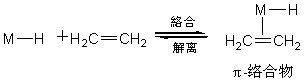
解离是络合的逆反应,即金属-配位体之间的共价键或配位体发生断裂使该配位体从络合物中解离下来的反应。它是均相络合催化中经常遇到的反应。
3.7.3.2 插入和消除
插入指的是与过渡金属原子配位结合的双键(例如烯烃、二烯烃、炔烃、芳烃和一氧化碳等配位体中的双键)中的π-键打开、并插入到另一个金属-配位体键之间。指齐聚的第二步基本反应就是乙烯的插入到M-H键之间。例如,上述乙烯齐聚的第二步基本反应就是乙烯的插入到M-H键之间
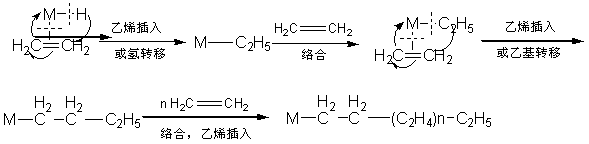 插入反应也可以看作是一个配位体(在这里是氢配位体或烷基配位体)从过渡金属原子上转移到一个具有双键的配位体(在这里是CH2=CH2)的β-位上。因此插入反应也叫做配位体转移反应或重排反应。
插入反应也可以看作是一个配位体(在这里是氢配位体或烷基配位体)从过渡金属原子上转移到一个具有双键的配位体(在这里是CH2=CH2)的β-位上。因此插入反应也叫做配位体转移反应或重排反应。
消除一般指的是一个配位体上的β-H(或其他基团)转移到过渡金属原子的空配位上,同时该配位体-金属之间的键断裂,使该配位体成为具有双键的化合物,从金属上消除下来,
3.7.4 均相络合催化的优缺点
3.7.4.1 均相络合催化的优点
(1)催化剂选择性好 因为在这里催化剂是以分子状态存在的。每一个催化剂分子都是具有同等性质的活性单位,而且一般都是按照其结构,突出一种最强的配位作用。另外,分子态催化剂的尺寸很小,对于多官能团的有机反应物分子,在同一瞬间只能有一个或少数几个官能团靠近催化剂分子,而处于有利于反应的位置。这对于反应的良好选择性提供了条件。而多相固体催化剂则不同,它的表面是非均一的,具有多种不同的活性中心,可以同时发生多种不同方向的反应。例如铂重整和催化裂化。
(2)催化剂的高活性 对于均相络合催化剂,由于中心过波金属原子和配位体的精心筛选,故每个催化剂分子不仅具有很高的选择性,还具有很高的活性。因此,溶液中络合催化剂的浓度远远低于固体催化剂表面活性组分的浓度。
(3)催化体系的预见性 均相络合催化剂在结构上分为中心过渡金属原子和配位体两部分,在研究和设计催化体系时,就按照改变中心金属原子和改变配位体的思路来调整其性能。这比气固相接触催化剂中助催化剂的筛选有较好的预见性。
例如,在丙烯的氢甲酰化制正丁醛时,最初用H-Co(CO)3做催化剂,反应要在140~180℃和25~30MPa下进行,而且正/异丁醛的比例只有3~4︰1。后来改用三苯基膦铑型催化剂,反应可在较温和的条件下进行,即在90~120℃和0.7~2.5MPa。而且正/异丁醛比可提高到10︰1。铑催化剂的用量约为丙烯的0.1%。已建有年产13.6万吨丁醛相7万吨丙醛的工厂。由此例可以看出铑催化剂的高选择性和高活性。
3.7.4.2 均相结合催化的缺点
(1)催化剂回收问题,在使用贵金属催化剂时特别重要。
(2)大多数均相络合催化剂在250℃以上是不稳定的,因此反应温度不宜过高。
(3)均相络合催化一般是在酸性介质中进行的,常常要求使用特种的耐腐蚀材料。
(4)有许多反应,特别是用一氧化碳为起始原料的羰基合成反应,常常需要高达30MPa的操作压力。
例如铑的价格比钴贵几千倍,在制备正丁醛时铑的损失如果是醛的百万分之一,则铑催化剂的费用也比用钴催化剂高好几倍,这就限制了均相络合催化的广泛应用。因此,它的应用比气固相接触催化小得多,只占全部催化反应的20%左右。在这里,产品丁醛的沸点比较低,可以用蒸馏法从反应液中蒸馏出来,从而完成了催化剂的回收,使生产过程易于工业化。
3.8 光有机合成
3.8.1 光子的能量与波长的关系
光是一种电磁波,它具有微粒性和波动性双重性质。微粒性说明光是由许多微粒组成。微粒的最小单元是光子。一个光子所具有的能量e与该光子运动时所产生的波长λ存在以下关系:e=hc/λ。
3.8.2 光对物质的作用
分子吸收光能的过程叫作“激发”。激发时分子从它的最低能量的“基态”跃迁到能量较高的激发态。分子跃迁的种类有分子的转动、分子的振动和分子中电子的跃迁。分子转动所需要的能量很小,只需要远红外区的低能辐射即可发生。分子的振动所需要的能量比转功能量大,常常需要红外区的辐射。分子中的电子从一个量子轨道跃迁到另一个较高能级的量子轨道叫作“电子能级激发”。基态分子M和激发态分子M﹡,虽然具有相同的分子组成和结构,但是它们的电子排列却不同。有了电子跃迁,激发态具有足够高的能量才有可能发生化学反应。电子跃迁所需要的能量比振动激发大10倍以上,它要求波长位于可见区和紫外区的较高能量的光辐射。因此,可见光和紫外光区叫作光化学反应区。例如,氯分子的光解离能是250kJ/mol(59.7kcal/mol),因此可计算出只需要波长λ小于479nm的紫光或紫外光就可以使氯分子解离为氯原子。又如,一般C-C 键的解离能约为335~377kJ(80~90kcal),而C-H键的解离能约为419kJ(100kcal)。当紫外光的波长为320nm时,它具有的能量约为373kJ(89kcal),因此这个紫外光,只能使C-C键断裂,而不能使C-H键断裂。应该说明,并非被分子吸收的光子都能引起化学反应,因为激发态分子可以通过其他途径失去能量而恢复为基态。
3.8.3 光量子收率
光化学中有两个基本定律。一个定律是只有被分子吸收了的光辐射才能激发光化学反应。另一个定律是一个分子只吸收一个光子。一个分子经光辐射后,通常吸收一个光子而产生激发态分子,然后根据不同情况而发生不同的过程。例如:
(1)经过极短的时间(约10-7~10-8s)把所吸收的光能重新辐射出来而产生萤光或磷光,即辐射跃迁。
(2)与其他分子碰撞,把光能转变为分子的平均能,即转变为热能;或者使其他分子活化。
(3)发生光化学反应。
光量子收率(φ)是表示光化学过程效率的量度,用以下公式表示。
φ=单位体积单位时间内参加反应的分子数/单位体积单位时间内吸收的光子数
一个光化学反应的量子收率大小,与反应的的结构性质和反应条件等因素有关。大多数非链锁光化学反应,其光量子收率在0~1之间。对于这类反应,消耗的光能太多,而且反应速度太慢,工业上很少采用。
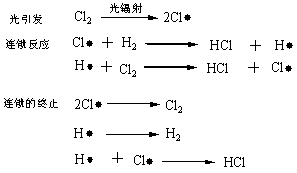
但是,对于链锁反应,则光量子收率可以高达10的几次方。例如,氯分子和氢分子在可见光的照射下,生成氯化氢的光量子收率可高达109左右。其反应历程如下:
这是因为一个氯分子吸收一个光子后,产生两个氯游离基,一个氯游离基与氢分子反应生成氯化氢和一个氢游离基。氢游离基再与氯分子反应又生成氯化氢和一个氯游离基。尽管有链锁终止的副反应,上述游离基链锁反应仍可继续循环下去,这就使得每吸收一个光量子可以生成几百万个以上的氯化氢分子。
在工业上,光有机合成主要用于链锁反应,因为它的光量子收率高,消耗的能量少。应该指出,产品的光量子收率与能量消耗有关,而产量收率则与物料消耗有关,这是两个完全不同的概念。
3.8.4 光化学反应的主要影响因素
光化学反应的主要影响因素与一般热化学反应并不完全一样。现扼要叙述如下。
3.8.4.1 能量来源
一般的热化学反应,本质上是由热能来提供反应过程所需要的活化能。热化学反应要求反应的总自由能降低。光化学反应是通过光子的吸收使反应物的某一基团激发而促进反应的进行。反应产物所具有的能量可以高于起始反应物所具有的能量。
3.8.4.2 光的波长和光源
所需光的极限有效波长是根据被激发的键所需要的能量而确定的。例如,氯分子的光解离能是250kJ/mol(59.7kcal/mol)。它需要波长小于479nm的紫光或紫外光,因此可以使用富于紫外光的日光灯作为光源。又如亚硝基氯(NOCl)在液相光解为NO·和C1·时,需要紫外光,这时必须使用高压水银灯作为光源,因为汞蒸汽能辐射253.7nm的紫外光。溴分子的光解离能是234kJ/mol(55.9kcal/mol)它只需要波长小512nm的可见光(蓝-紫区)即可。
3.8.4.3 辐射强度
光化学反应的速度主要取决于光的辐射强度。有些简单的光化学反应,其速度只取决于光的辐射强度,而与反应物的浓度无关。
3.8.4.4 温度
对于一般有机反应,温度每升高10℃反应速度约增加2-3倍。而大多数光化学初级反应的速度,则受温度的影响较小。在有机合成反应中,光子把分子活化后,常常接着还有几步非光化学反应。这时,如果决定整反应速度的是后面的非光化学步骤,那么温度的影响将与一般热化学反应相似。
3.8.4.5 溶剂
溶剂对光化学反应的影响研究得还很不充分。对于在有机合成中最常遇到的游离基反应来说,不宜选择会导致游离基销毁的溶剂,而应选择有利于保存游离基的溶剂。例如,在甲苯侧链氧化时,常用CCl4做溶剂,这不仅是因为在非极性溶剂中氯分子较易光解为氯原子,还因为CCl4会通过以下交换反应较易保存氯原子,从而增加了光量子效率。
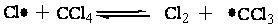
3.9 电解有机合成
3.9.1 概述
70年代初告发了公害问题,制订了有关三废治理的法规。另外,石油价格上涨,导致能源和工业原料价格也随之上涨。这就迫使企业对现有技术重新评价。要求化工技术必须考虑无公害、省能源、省资源。在此背景下,电解有机合成,出于其能量效率高,能够用于多种资源,进行清洁生产等特点而引起重视。此后,电解有机合成在技术上和理论上都有了很大发展。据初步统计,在80年代初,电解有机合成技术已经工业化的有四十多个,已经完成和正在中试的还有十几个。电解有机合成可适用的反应类型。同一个有机原料,在不用条件下可生成多种不同产物。例如,硝基苯在不同条件下进行阴极电解还原可分别制得苯胺、对氨基酚、对胺基苯甲醚和联苯胺四个产品。另外,有些化工产品采用电解有机合成法。原料易得,可一步直接制得产品,比非电解有机合成法具有独特的优点。例如,辛酰氯的氧化氟化制全氟辛酸、呋喃醇的氧化取代制麦芽酚和乙基麦芽酞、已二酸单酯的氧化脱羧偶联制癸二酸双酯、苯的氧化/还原制对苯二酚、丙烯腈的加氢偶联制己二腈等。其中有些产品采用电解有机会成法,最为经济合理。例如,丙烯腈的加氢偶联制己二腈,美、英等国已有年产10万吨的装置,连电费较贵的日本也已工业化。预计今后明有机合成将会有更大的发展。
3.9.2 电解过程的基本反应
所有的电解槽都有两个与电解液相接触的电极。电化学反攻是在电极与电解液的界面上发生的。在阳极,有机反应物R-H发生失电子作用(氧化),转变为阳离子基(R-H)+。在阴极、有机反应物发生得电子作用(还原作用)而转变为阴离子基[R-H]-。

3.9.3 电解过程的反应顺序
反应顺序指的是为了得到目的产物,起始反应物在电解槽中所经历的电化学步骤(E)和化学步骤(C)的顺序,即反应历程。例如,丙烯腈在阴极电解加氢二聚(偶联)生成己二腈的反应顺序可以表示如图所示。
因此,由丙烯腈生成己二腈可能有四个反应历程,其反应顺序分别为:ECC,ECCC和ECECC或ECCEC。对于其他反应,还可以有ECE、EEC、CEC等不同的反应顺序。
在阴极,由丙烯腈生成己二腈的总反应式可简单表示如下:
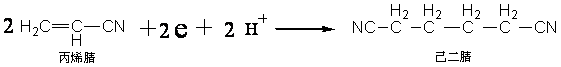
 丙烯腈电解加氢二聚(偶联)生成己二腈的反应顺序
丙烯腈电解加氢二聚(偶联)生成己二腈的反应顺序
从上例可以看出,丙烯腈的电解加氢二聚的有机反应是在阴极发生的,这个电极叫做“工作电极”。另一个电极(在这里是阳极)并不发生有机反应,只是配合阴极向有机反应提供质子,这个电极叫做“辅助电极”。大多数电解有机合成过程只利用一个电极发生目的有机反应。只有少数过程才利用两个电极都参加有机反应。例如,苯在阳极氧化成对苯醌,然后在阴极还原成对苯二酚。
3.9.4 电解反应的全过程
电解过程中除电化学反应(E)和化学反应(C)以外,还涉及到许多物理过程,例如扩散、吸附和脱吸附等。现在以丙烯腈按ECC顺序生成己二腈为例,其全过程至少包括以下七个步骤,如图所示。
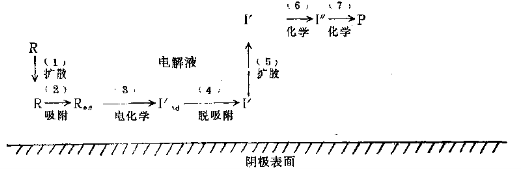
由丙烯腈按ECC生成己二腈的全过程
(1)反应物分子R(即丙烯腈)在电解液中由于扩散和泳动到达阴极表面。
(2)R在阴极表面上被吸附成为吸附反应物Rad,在这里主要是物理吸附,有时也有化学吸附。
(3)Rad与阴极之间发生电子转移反应,生成被吸附的中间体I`ad(即丙烯腈得电子生成-CH2-CH2-CN阴离子基)。
(4)I`ad从阴极表面脱吸附,成为脱吸附的中间体I`。
(5)阴极表面的I`向电解液中扩散或泳动,离开阴极表面。
(6)I`在电解液中发生化学反应,生成中间体I``
(7)中间体l`在电解液中进一步发生化学反应,生成产物P(即-CH2-CH2-CN的二聚生成己二腈)。至此,阴极的电解反应全过程完成。
过程(1)和(5)的物质移动是物理过程。在工业生产中,它常常会成为限制反应速度的重要因素。它关系到电解槽的设计和操作条件的确定,必须作为化学工程问题来考虑。
过程(3)是电化学过程,它是电解反应中层重要的过程,也是我们讨论的中心。
过程(6)和(7)是化学过程。它是有机化学的研究对象,但是所确定的反应条件不应该干扰必要的电化学过程和物理过程。
过程(2)和(4)的吸附和脱吸附过程,除与有机生成物的立体有择性有关的场合以外,一般不做太多的考虑。
3.9.6 电解有机合成的优缺点
主要优点
(1)在许多场合具有选择性和特异性(见下)。
(2)不需要使用价格较贵的氧化剂和还原剂。
(3)反应可在温和的条件下进行。
(4)是节能的方法,其电费比许多氧化剂和还原剂经济得多。
(5)可以是无公害的清洁反应。
主要缺点:
(1)电解设备复杂,专用性强。
(2)影响因素多,最佳条件的选择和电化学工程技术的处理比较复杂。
(3)常常需要使用有机溶剂。
(4)对于可用空气作氧化剂或用氢气作还原剂的反应,竞争力差。
(5)电费是成本的主要部分。对于要求一次转化率接近100%的反应,电流效率低、电费高。
3.9.7 电解有机合成的工业应用实例——己二腈的生产
己二腈是生产尼龙66的重要中间体,在工业上主要有四种生产方法。
(1)己二酸二铵盐在磷酸脱水催化剂的存在下,在200~300℃脱水先生成己二酰胺,再脱水生成已二腈。
(2)丁二烯经中间体l,4-二氯丁烯,间接氢氰化。
(3)丁二烯在均相络合催化剂存在下直接氢氰化.
(4)丙烯腈的电解加氢二聚制己二腈。
这四种方法各有忧缺点,但是在总能耗上丙烯腈法最低,其耗电费用只占生产费的5%。因此,就是电费较高的日本也已采用此法。
丙烯腈法是美国孟山都公司首先开发的。它所采用的电解槽是隔膜式电解槽。隔膜是由磺化聚乙烯树脂所制成的离子交换膜。电极板是一面阳极、一面阴极的双极式电极扳。阳极是铂,阴极是铅。电解槽型式是板框压滤机型。每块电极板的面积是0.93m2,极间距很小,许多块电极板和隔膜用聚丙烯制的方框组合起来。阴极室电解液的组成是丙烯腈40%,四乙基铵对甲苯磺酸盐34%,水26%。阳极室的电解液是稀硫酸。两种电解液分别连续地流过阴极室和阳极室。阴极电解液经处理后,已二腈的收率为90~93%。槽电流密度50~100A/L,电流效率90~92%,电耗6.6~7.7kw/Kg。
其他国家的许多公司还对丙烯腈法开发了不少新的专利。其中包括电极和电解液的改进,不用隔膜以及电解槽的设计等。