第二十五章 有机合成
在科研中,若从天然产物中得到一个很有用的化合物,我们采取的一般步骤是纯化,确定其结构,若为一新化合物,我们就用人工已知、可靠的合成方法把它合成出来,以验证其结构。所以,有机合成路线设计是有机化学工作者必备的手段。合成路线的好坏,也反映出一个化学工作者的知识水平与能力。
有机化学合成路线设计方法通常是倒推法,也叫逆合成分析。
合成设计的一般程序为:
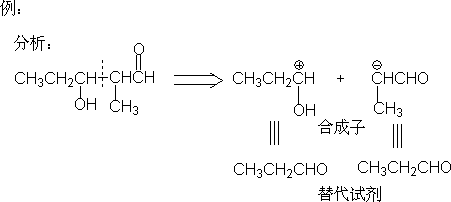
1.分析
a.认出目标分子中的官能团。
b.用已知和可靠的反应进行切断。
c.必要时重复进行切断,直至达到易于取得的起始原料。
2.合成
a.根据分析,写出合成计划,加进试剂和条件;
b.根据实验中遇到的失败和成功,修改计划;
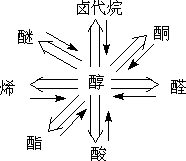
§1.碳 胳
一.碳胳的切断与合成
㈠ 切断介绍
⒈主导思想:切断是为了合成,切断时一定要想到合成。
⒉分子碎片要有合适的试剂代替,并容易得到。
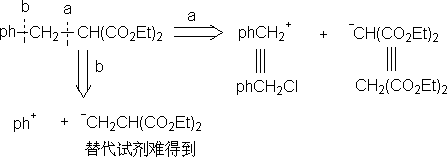
⒊要有合适的反应。(最好有合理的机理)
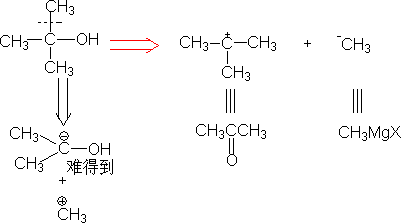
⒋切断时,不可能切断成两个近乎相等的分子碎片,有对称性时按对称性切开(目的:合成步骤少)。
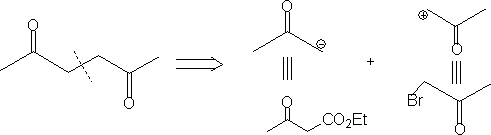
⒌在没有合适的反应相对应时,回推到适当阶段,再切断。
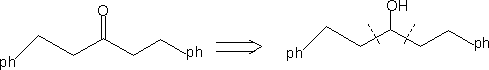
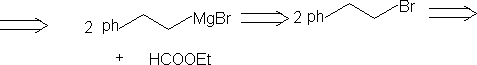
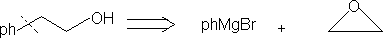
⒍加入活化基团,帮助观察,切断,反应后脱去活化基团。
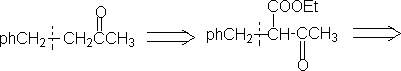

⒎加入保护基,反应后脱去。
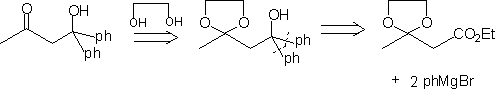
⒏副产物少。


㈡ 一.基团的切断。
1.简单醇的切断
① 叔醇

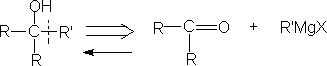
② 仲醇
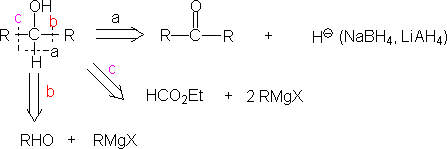
2.醇衍生物的切断
3.简单烯烃的切断
①烯至醇
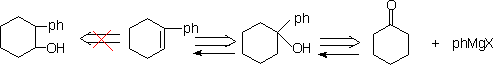
③ 烯至酮+wittig试剂 (wittig 反应)
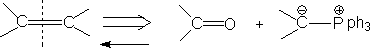
④ 烯至炔
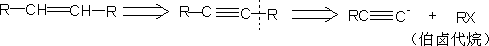
4.芳香酮的切断
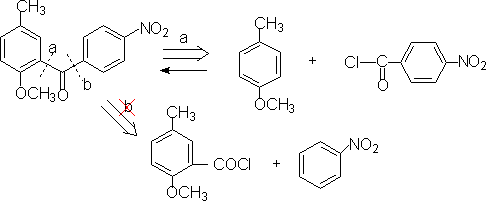
5.简羧酸及其衍生物的切断
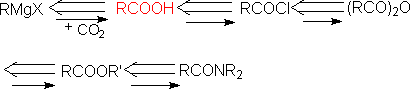
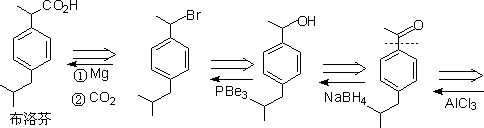
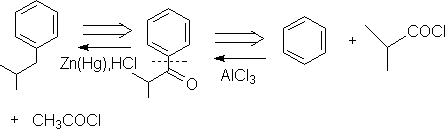
㈢ 二基团的切断
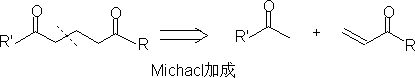
1. 1,3-二官能团化合物和α
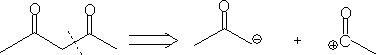 ,β-不饱和羧基化合物。
,β-不饱和羧基化合物。
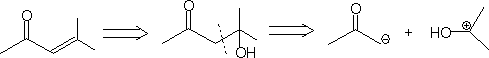

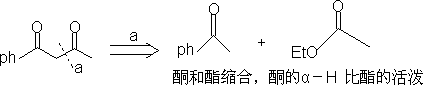
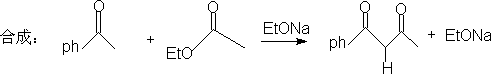
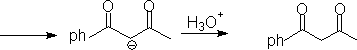

2. 1,5-二羧基化合物
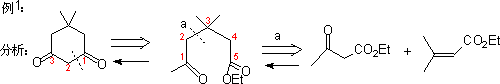
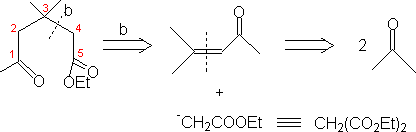

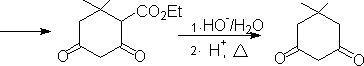
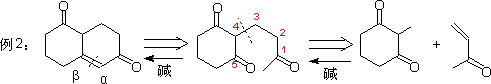
3. 1,2-二官能团化合物
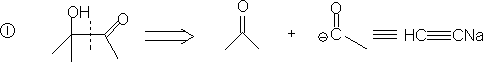
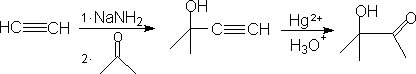
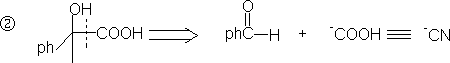
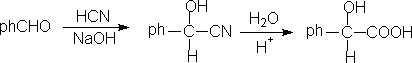
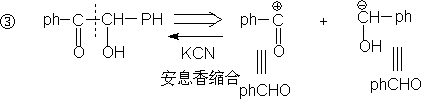
4. 1,4-二官能团化合物
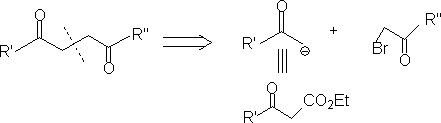
5. 1,6-二官能团化合物
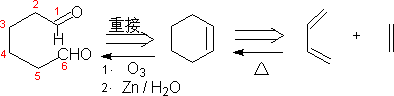
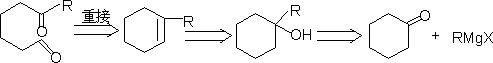
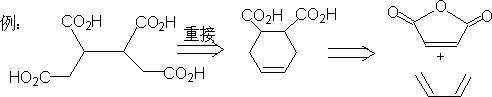
㈣ 碳环化合物的合成
1.小环化合物

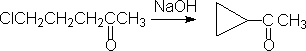
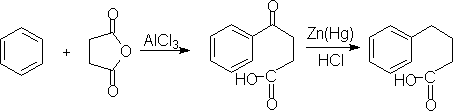
2.稠环芳烃
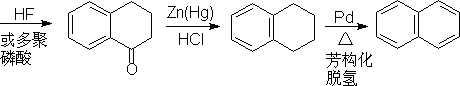
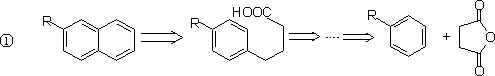
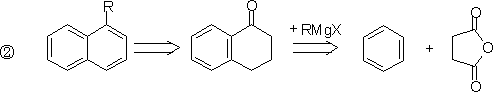
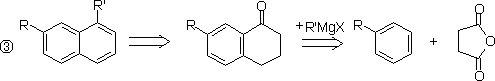
§2.官 能 团
官能团的引入(自学)
1.选择性反应
2.官能团保护
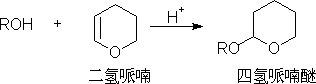
四氢哌喃醚,对碱、格氏试剂、烃基锂、催化加氢及氧化剂稳定,容易被稀酸分解。
3.基团占位
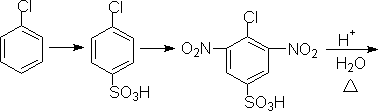
磺酸基占位

§3.构 型
在有机合成中,有时产物需要一定的立体要求。
1.获得顺式或反式产物 (自学)
烯烃:

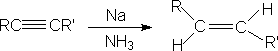
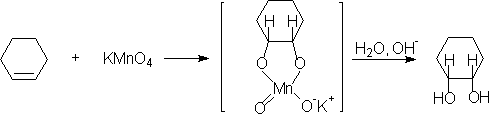
二醇:
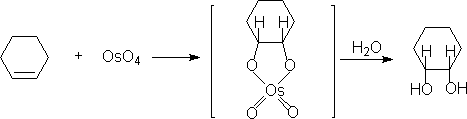
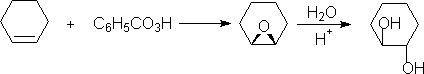
2.环的骈联
环连接点的主体要求也是复杂的工作。如合成:
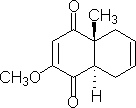
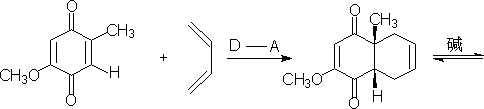
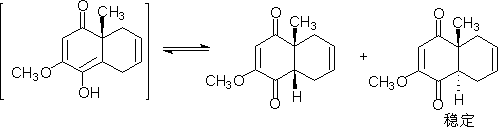
由于α位有羰基,在碱催化下可以发生酮与烯醇式互变,并且并联的环反式比顺式稳定可以利用这点,得到反应产物。
3.不对称合成
有机合成是对有机化学家创造能力的一种检验。近来,各种天然产物的复杂结构(多至数十个手性中心)和各种有理论意义化合物的特殊结构都向有机合成化学家提出了新的挑战。对于有机合成,除了在反应条件上要求尽量温和外,在选择性上也要求有化学选择性,区域选择性,立体选择性及对应选择性。特别是对映选择性,是人们努力奋斗的热点。可以说对映选择性的有机合成是对有机化学家创造能力的最好检验。实现对映选择性的合成,也就是手性合成,不对称合成问题。
不对称合成是指在一个反应中使非手性的分子转变为手性分子,在产生的手性分子中,对映异构体的含量是不等量的。
一般来说,实现不对称合成的途径有五个:
⑴ 手性底物的诱导
通过底物原有手性的诱导,在产物中形成新的手性中心。很多天然产物的立体控制的全合成,往往选择一个手性的原料出发。如:青蒿素的全合成就是从手性的香茅醛或是手性的异胡薄荷醇开始的。目前常选用的手性起始物有萜类,氨基酸,糖类等。
⑵ 手性辅助的诱导
在合成的某一个阶段,引入一个手性辅助物,形成局部的诱导,产生一个新的手性中心。如利用手性醇来生成酯或是缩醛、酮,或是利用手性的胺来生成酰胺。这种手性辅助物往往要在反应后除去。
⑶手性试剂的控制
⑷手性催化剂的控制
⑸手性环境的影响
手性环境包括溶剂,相转移催化剂等。
以上各种途径都是利用底物或辅助物的手性,试剂或催化剂的手性。与反应物结合时,形成非对映异构的过渡态。于是对不同面的进攻产生差异,从而产生了反应的对映选择性。
对映体过量百分数(%e.e.) 即enantiomeric excess %
%e.e=([R]-[S]) / ([R]+[S])×100%=%[R]-%[S]
%e.e越高,说明产物光学纯度越高,不对称合成选择性越好。
例1.铑催化的不对称氢化反应
这是美国孟山都公司用以制取治疗帕金森综合的特效药物L-Dopa的方法。
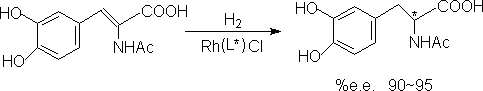
例2.钛催化的不对称环氧化反应
这是Baker公司用以制备千毒蛾性引发剂的方法。1980年这种性引发剂每克售价高达一千英镑。而采用不对称合成法后,价格降至每克一百英镑。千毒蛾性引发剂(dispalure)的结构式为:

林国强等从C11端开始利用sharpless不对称环氧化,同时进行了动力学拆分,而后直接利用铜锂试剂进行开环:

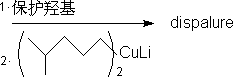
这个方法使用于烯丙醇衍生物,用的试剂是叔丁基过氧化氢,四异丙氧基钛和酒石酸酯。这里的酒石酸酯是手性的来源。用天然的L-(+)酒石酸酯和非天然的D-(-)酒石酸酯所得的环氧化物的构型是相反的。该法所用的试剂都是简单易得的,反应产率一般在80%左右,所得的e.e.值往往大于90%。这个方法可以同时引入两个手性中心。加上环氧环在开环以后可能有多种变化,因而,引起人们很大的重视,并在很多天然产物的合成中得到应用。
这种方法只限于烯丙醇类的衍生物,对于一些没有相邻的羟甲基的烯烃化合物,e.e.值是不高的。
参考书:黄耀曾,钱延龙 《金属有机化学进展》化学工业出版社(1987) P28(戴立信)
§4.合成路线的选择
要求: (1)原料易得; (2)产率高,副反应少,易纯化; (3)步骤少; (4)操作方便、安全