第21章 碳水化合物
§1 单 糖
单糖中最重要,最常见的是葡萄糖和果糖。而且从结构和性质上可以作为各种单糖的代表。我们主要以葡萄糖和果糖为例来讨论单糖的结构,构型,构象和它们的理化性质。
一、单糖的构造式
葡萄糖:
实验事实:
1. 碳氢定量分析,实验式 CH2O
2.经分子量测定,确定分子式为C6H12O6.
3. 能起银镜反应,能与一分子HCN加成,与一分子NH2OH缩合成肟,说明它有一个羰基。
4. 能酰基化生成酯。乙酰化后再水解,一分子酰基化后的葡萄糖可得五分子乙酸,说明分子中有五个羟基。
5. 葡萄糖用钠汞齐还原后得己六醇;己六醇用HI彻底还原得正己烷。这说明葡萄糖是直链化合物。
按照经验,一个碳原子一般不能与两个羟基同时结合,因为这样是不稳定的,根据上述性质,如果羰基是个醛基,则它的构造式应是:

用醛氧化后得相应得酸,碳链不变。而酮氧化后引起碳链的断裂,应用这一性质就可确定是醛糖或酮糖。葡萄糖用HNO3氧化后生成四羟基己二酸,称葡萄糖二酸。因此,葡萄糖是醛糖。
6. 确定羰基的位置。葡萄糖与HCN加成后水解生成六羟基酸,后者被HI还原后得正庚酸,这进一步证明葡萄糖是醛糖。

同样的方法处理果糖,最后的产物是α-甲基己酸。

α-甲基己酸
因此,果糖的羰基是在第二位。 综合上述反应和分析,就确定了葡萄糖和果糖的构造式。
二、 单糖的立体构型
葡萄糖分子中有四个不对称碳原子,因此,它有24 =16个对映异构体。要想知道,哪一个是葡萄糖分子,就得确定它们的立体构型。
1. 相对构型(D系列和 L系列)
在1951年以前还没有适当的方法测定旋光物质的真实构型。这给有机化学的研究带来了很大的困难。当时,为了研究方便,为了能够表示旋光物质构型之间的关系,就选择一些物质作为标准,并人为地规定他们的构型,如甘油醛有一对对映体(+)—甘油醛和(-)—甘油醛。
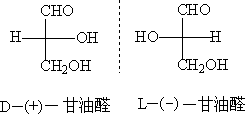
(Ⅰ ) ( Ⅱ)
当时认为规定右旋的甘油醛具有(Ⅰ)的构型(即当醛基—CHO排在上面时 ,H在左边, OH 在右边),并且用符号“D“标记它的构型“dextro”即右旋;左旋的甘油醛具有(Ⅱ)得构型,用符号 L标记它的构型“levo”即左旋。右旋甘油醛就称为D-(+)-甘油醛,左旋甘油醛称为L-(-)-甘油醛,在这里+、- 表示旋光方向,D,L表示构型。
构型与旋光性之间没有一一对应关系。
标准物质的构型规定以后,其他旋光物质的构型可以通过化学转变的方法与标准物质进行联系来确定。由于这样确定的构型是相对于标准物质而言的,所以是相对构型。我们把构型相当于右旋甘油醛的物质都用D 来表示,而相当于左旋甘油醛的都用L表示。即由D-甘油醛转化的物质,构型为D。(转化过程不涉及手性碳化学键的断裂)
如 :

D-(+)-甘油醛 L-(-)-甘油醛
这样,通过与标准物质的反应联系,一系列化合物的相对构型也就可确定了。
确定了甘油醛的构型以后,就可以通过一定的方法,把其它糖类化合物和甘油醛联系起来,确定其相对构型,如:

从D-赤藓糖和D-苏阿糖出发,用与HCN加成水解,还原等同样方法,可各衍生出两个戊糖,共四个D-戊醛糖,从四个D-戊醛糖出发可各得两个己糖,共八个D-己醛糖。

差向异构体:像这样含有多个手性碳原子的异构体中相应的手性碳原子只有一个构型不同,其余构型都相同。这种异构体称为差向异构体。
这里是C2构型不同,所以称为C2差向异构体。
1951年J.M.Bijvoet通过X射线分析法,测得了右旋酒石酸的构型,这种实际测定得构型称为绝对构型。因此推出人为规定的甘油醛的构型与实际的构型完全符合。这样,与标准物质甘油醛联系而得到的旋光物质的相对构型也就都是绝对构型了。
2. 构型的标记与表示方法:
天然产物中,仍沿用着D,L名称对构型进行标记。天然产物的葡萄糖为D-构型。此外也采用R,S标记法。
表示方法:

D-葡萄糖
用一直线表示碳链,用一短线表示羟基,用一长横线表示羟甲基,用△表示醛基。
构型还可以用另外一种表示方法,用楔形线表示从纸平面出来向着我们的键,虚线表示向着纸平面后离开我们的键。
三 、单糖的反应,构型的测定
1. 单糖的反应
⑴ 生成脎:
由于醛糖是一个醛,故能与苯肼反应形成苯脎,如果使用过量的苯肼,就发生进一步的反应,生成通称为脎的产物。
每个脎分子含两个苯肼残基。

醛糖脎
这是α-羟基醛和α-羟基酮的典型反应。(α-OH基团究竟如何被氧化还不甚清楚)
有人认为:
糖大多数是α-羟基醛或酮,所以能生成脎。生成糖脎的反应是发生在C1和C2上。

所以,若在第二个碳上构型不同而其他碳原子构型相同的差向异构体,必然生成同一个脎。例如:
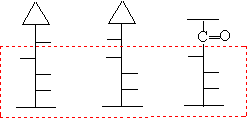
D-(+)-葡萄糖 D-(+)-甘露糖 D-(-)-果糖
因此,他们生成同一个脎(D-葡萄糖脎)。
糖脎是不溶于水的黄色结晶,不同的糖脎晶形不同,在反应中生成的速度也不同。因此可以根据糖脎的晶形及
生成时间来鉴定糖。由于糖的差向异构体可生成同一个脎,只要知道其中的一种构型,其它一种也就知道了。
(1) 氧化反应
(ⅰ)和Tollen,Fehling,benedict试剂反应分别生成银镜和砖红色沉淀
 银镜
银镜
葡萄糖
果糖
酮糖能被Tollen或Fehling试剂等弱氧化剂氧化,这是α—羟基酮特有的反应。
这两种氧化剂都是碱性试剂,在稀碱液中醛糖和酮糖还能发生一种互变异构—差向异构作用。即发生了
酮式—烯醇式的互变异构;他们存在下列平衡
§2 单 糖的反应

醛糖 烯二醇
1. 和溴水反应:
溴水能氧化醛糖,但不氧化酮糖,可以利用这个反应来区别醛糖和酮糖。

2. 和HNO3反应:
稀HNO3氧化作用比溴水强,能使醛糖氧化成糖二酸。


(酮糖在同样的条件下氧化导致1-2键断裂)
(ⅳ)和高碘酸的反应:

这一试剂有高度区域选择性,只断裂α,β-二醇间的C-C键
(3) 醛糖碳链增长法-克利安尼—费歇尔(Kiliani-Fischer)合成法

(γ,δ-羟基酸容易形成内酯)
(4)糖的递降反应:就是由高级糖变为低级糖,现在有好几种方法可由糖的醛基开始,
去掉一个碳原子,使一个糖变成比原来少一个碳原子的糖。 (参考书 邢其毅 P640-641 ;
Andrew Streltwleser,Jr.Clayton H.Heathcock,introdudtion to Organic Chemistry Csecond Edition P917)
① 佛尔(A.Wohl)递降反应。
可以看作是羟氰合成的逆向反应。如D-葡萄糖肟,经醋酐的作用后,失去一分子水变为氰基。分子
中的羟基被乙酰化。在银氨络合物的作用下,即失去氰基,同时乙酰基被氨解为乙酰胺。它又和生成出
来的醛基反应变为二乙酰胺的衍生物。然后用稀盐酸水解,即得到D-阿拉伯糖。

此法通过齐柏林(G.zemplen)的改进,用甲醇钠去掉CN基,产量比原来的佛尔法要高一倍。如:

D-ribose

D-erythrose
② 芦福(O.Ruff)法
如D-葡萄糖酸的钙盐在Fe3+或氧化汞的作用下,通过过氧化氢的氧化,得到一个不稳定的α-羰基酸,
失去二氧化碳后,也得到低一级的D-阿拉伯糖。

不稳定D-阿拉伯糖
③ 2,4-二硝基氟苯法:把糖溶于碳酸氢钠水溶液中,使之与2,4-二硝基氟苯反应,然后分解即得低一级的醛糖, 产率一般为50%-60%。

3.构型的测定 (请参考莫里森(下册) 903-907页)
(+)-葡萄糖是一种己醛糖,但作为一个己醛糖,它有四个手性中心,可以有16种可能的构型。
问题是它应是哪一种构型?1888年,Emil Fischer(Wvrzburg(浮兹堡)大学)开始寻找这一问题的
答案,并在1891年宣告完成了一项杰出的化学研究,他为此于1902年获得了诺贝尔奖金。现在
让我们按照Fischer的步骤来确定(+)-葡萄糖的构型,虽然略有修改,但以下的论证基本上都
是由Fischer提出的。
1888年那时只有很少一些单糖是已知的,其中有(+)-葡萄糖,(-)-果糖,(-)-阿拉伯糖。
(+)-甘露糖在那时刚刚被合成出来。当时已经知道(+)-葡萄糖是一个己醛糖,而阿拉伯糖
是一个戊醛糖。Emil Fischer已发现(1884年)苯肼可以把碳水化合物变成脎,Kiliani的增长碳链
的氰醇法刚刚只有两年历史。
为了使问题简化,Fischer于是只考虑C-5的-OH在右边的那些构型(D-型),而不考虑其他八个可能的
构型(L-型),他认为任何导致在这些式子中选中一个式子的论点同样能适用于它的镜像体。
因为他的证明法部分的依赖于(+)-葡萄糖与戊醛糖(—)-阿拉伯糖(树胶糖 )之间的关系。所以,
Fischer也必须考虑五碳醛糖的构型。在八个可能的构型中,他只保留其中四个(D-构型的)


Ⅰ Ⅱ Ⅲ Ⅳ
D-(-)-核糖 D-(-)树胶糖 D-(+)-木糖 D-(-)-异木糖
它们又是那些-OH在最下面手征性中心右边的构型。
证明的方法如下:
(1) 用硝酸氧化(-)-阿拉伯糖时,生成一个旋光性的二元羧酸。因为在最底下的手征性中
心上的-OH任意的被规定放在右边,所以这个事实就意味着在最上面的手征性中心上的-OH是在左边。

(-)-阿拉伯糖
有旋光性Ⅱ或Ⅳ


Ⅰ无旋光性 Ⅲ 无旋光性
(2) (-)-阿拉伯糖能通过Kiliani-Fischer合成法转变成(+)-葡萄糖和(+)-甘露糖。
所以,(+)-葡萄糖和(+)-甘露糖是差向异构体,其区别只在于C2上的构型不同,
而C3,C4,C5上的构型是和(-)-阿拉伯糖中的构型是一样的。(+)-葡萄糖和(+)-甘露糖必定是:

(-)-阿拉伯糖 (+)-葡萄糖和(+)-甘露糖为差向异构体, C-4羟基位置不定。 Ⅱ或Ⅳ
(3) 用硝酸氧化(+)-葡萄糖和(+)-甘露糖时都产生有旋光性的二元羧酸。
这意味着C-4上的-OH,是在右边。


(+)-葡萄糖 ( +)-甘露糖
有旋光性 有旋光性
与实验事实相符。
C-4的-OH在左边:


无旋光性 有旋光性
与实验事实(3)不符。说明C-4上的-OH在左边的不是(+)-葡萄糖和(+)-甘露糖的构型。
(-)-阿拉伯糖必定有同样位于右边的-OH,因此它具有构型:

(-)-阿拉伯糖
虽然(+)-葡萄糖和(+)-甘露糖具有

的构型,但是还有一个问题有待解决:哪个化合物是葡萄糖或甘露糖的构型?
还需进一步加以证明。
⑷ 氧化另一个己糖(+)-古罗糖,象氧化(+)-葡萄糖时一样,也生成(+)-葡萄糖二酸。说明两种己醛糖能生成葡萄糖二酸。如果我们考察(+)-葡萄
二酸的两种可能的构型:A,B,

(a) A (a’)
D-(+)-葡萄糖 葡萄糖二酸 L-(+)-古罗糖
a≠a’是另一个己醛糖

(b) B (b’)
(+)-甘露糖 甘露糖二酸 (旋转180°) b=b’
说明B二酸,只能从一个己糖衍生出来,则说明B二酸不是葡萄糖二酸。而A二酸能从两种
不同的己糖衍生出来,符合实验事实(4),则说明它为葡萄糖二酸。推之:(a)为(+)葡萄糖((+)-甘露糖的C2差向异构体),a’ 为(+)-古罗糖,那么,b为(+)-甘露糖。
§3. 葡萄糖
1. 环状结构:
前边讲的D-葡萄糖是一个五羟基己醛,可以起醛类的一些反应 。
早在1885年前药物学家坦瑞特(Tanret)就分离出物理性质不同的两种 D-葡萄糖。一种是我们称为α-D-葡萄糖,熔点为146℃,比旋光度+112 °,另一种是 β-D-葡萄糖,熔点是150℃,比旋光度+19°。两者之中任何一种当溶解在水里时溶液的比旋光值都逐渐发生变化,直到+53°达到平衡(邢其毅“基础有机”是52.7°),旋光度值不再改变。两种葡萄糖的溶液分别改变旋光,达到一个恒定值的这种现象叫做变旋现象。
但是,还有以下一些现象:
(1)不起一些醛类的典型反应:如与品红试剂不变色,与亚硫酸氢钠不发生加成。
(2)有变旋现象:
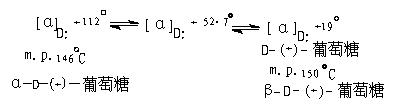
新配制的m.p.为146℃的D-葡萄糖溶液,[α]D+112℃, 逐渐减少至达到平衡时[α]D为+527℃。新配制的熔点为+150℃的D-(+)-葡萄糖溶液,比旋光度[α]D +19°。逐渐增高至平衡时也为+52.7°,这种现象称为变旋现象。则有较高的正旋光值的形式称为α-D-(+)-葡萄糖,具有较低旋光值的形式称为 β-D-(+)-葡萄糖。
(3)当D-(+)-葡萄糖用甲醇和HCL处理时产物为只含有一个-CH3基的葡萄糖苷。
如果醛糖分子确有醛基的话,理应和两分子醇形成缩醛:

从以上事实,人们得出D-(+)-葡萄糖环状结构的概念。这里先从配糖物说起,以后再逐渐说明其他问题。
为什么葡萄糖中醛基只与一分子醇作用呢?这是由于醛糖中醛基可先与它自己分子中的羟基生成一个半缩醛,半缩醛与一分子甲醇失水而生成缩醛。若葡萄糖(-CHO)醛基与C-5的羟基反应则半缩醛为:
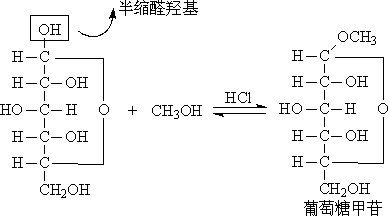
凡糖的半缩醛式羟基(简称为苷羟基)与另一个羟基化合物失水而生成的缩醛均称为“配糖物”,简称为“苷”,苷是缩醛。苷分解后生成糖和非糖部分,非糖部分叫做配基或配质。糖的部分叫做糖苷基,名称为某糖某苷,如葡萄糖甲苷。
2.环的大小:醛糖既可成半缩醛式存在,那末醛糖中究竟哪一个羟基与醛基缩合而成半缩醛呢?这就是环的大小问题。
① 把葡萄糖甲苷甲基化可得到O-五甲基葡萄糖。
 O-五甲基葡萄糖
O-五甲基葡萄糖
② O-五甲基葡萄糖中五个甲氧基是不一样的,在第一个碳上的甲氧基是缩醛,容易被稀盐酸水解,而其他四个甲氧基则保留不变。

O-四甲基葡萄糖
(半缩醛式) (开链式)
③ 硝酸与O-四甲基葡萄糖反应,生成O-三甲基木糖二酸,无旋光性:
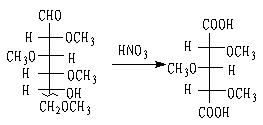 (无旋光性的)
(无旋光性的)
O-三甲基木糖二酸
因此证明,葡萄糖的半缩醛式是由第五个碳上的羟基和醛基缩合成半缩醛的,也就是六元环。用X-射线衍射法证明,己醛糖的环状结构在大多数情况下都呈六元环而存在。
3. 环状构型的表示法
A .Fischer投影式对葡萄糖来说,已被测定是第五个碳原子上的羟基与醛基形成一个六元环。

β-D-葡萄糖 D-葡萄糖的开链式 α-D-葡萄糖
在形成环状结构的过程中,在第一个碳原子上产生一个新的手性中心,给出两种异构体,它们仅在第一个碳上构型不同。按照惯例,环状葡萄糖的Fischer投影式中(其他糖也同样),α- 异构体的端基碳上羟基向右,而β-异构体的端基上的羟基向左。
B. 哈沃斯(Haworth)透视式
注意,在Fischer投影式转变为Haworth透视式时应当遵循下述两条规则:
(1) 所有在Fischer投影式中连在手性中心右边的羟基应当在Haworth式中指向环平面下边。反之,在Fischer投影式中出现在左边的羟基在Haworth式中将指向环平面的上方。
(2) Fischer式中属于D-系的糖的尾基-CH2OH在Haworth式中应指向环平面的上方,L-系糖的尾基-CH2OH在Haworth式中将指向环平面下方。

 α-D-半缩醛(-OH向外)
α-D-半缩醛(-OH向外)
α-D-(+)-葡萄糖 α-D-(+)-葡萄糖(或α-D-(+)-吡喃-葡萄糖)
Fischer投影式 Haworth透视式


β-D-(+)-葡萄糖 β-D-(+)-葡萄糖(或β-D-(+)-吡喃-葡萄糖)
Fischer投影式 Haworth透视式
C 构象式表示法:
Haworth透视式比Fischer投影式更能合理的表达单糖的存在形式,但是吡喃糖只用一个简单的平面式表示还是不够合理的。从构象分析的基本概念出发,我们知道一个分子处在自由稳定状态时要求他的每个碳原子尽可能保持的四面体形状,也就是分子尽可能保持正常键角,尽可能的减少基团间空间排斥,以降低内能。对环己烷来说,稳定的构象是椅式构象。而吡喃糖环正好类似于环己烷。

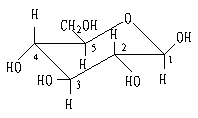
α-D-(+)-吡喃-葡萄糖 β -D-(+)-吡喃-葡萄糖
我们发现在构象式中,α-体的C1位上羟基取a键,它与C3和C5位上氢原子(a键)有空间排斥效应(1,3作用)。而β-体的位上羟基取e键,没有1,3作用而且环上所有比较大的基团都处在e键,相互之间距离最远,没有空间排斥效应。因此β–体应比α-体更稳定,内能更低。这符合实际情况。在水溶液中达到平衡时β-体占63%,α-体占37%。
4.环式和链式异构体的互变


α- ~37% ~0.1% β- ~63%
由于半缩醛环的易打开和关闭,两个异头物都可经由开链式转变成含有这两种环状异构体的平衡混合物,就造成了变旋光作用。
在溶液中D-葡萄糖开链结构量虽很少,但能被氧化或与HCN加成,因为这些反应是不可逆的。而品红试验是可逆反应,微量的醛基化合物存在,不足以显示反应的进行。
5.其它环状糖的构型:
1.D-果糖

 β-D-(-)-果糖(Fischer式) α-D-(-)-果糖 (Fischer式)
β-D-(-)-果糖(Fischer式) α-D-(-)-果糖 (Fischer式)
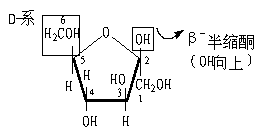

β-D-(-)呋喃果糖Haworth式 α-D-(-)呋喃果糖Haworth式
2. D-半乳糖
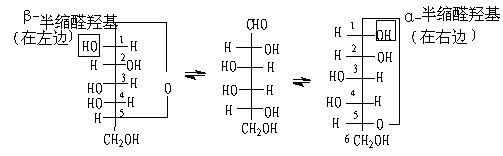
β-D-(+)-半乳糖 α-D-(+)-半乳糖

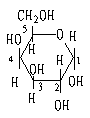
β-D-(+)吡喃-半乳糖 α-D-(+)吡喃-半乳糖
D-葡萄糖与D-半乳糖的区别主要是C4的-OH构型相反。还是1970年才完成的。
果糖的α,β 型:


α-D-(-)呋喃果糖 β-D-(-)呋喃果糖
§4. 双 糖
一 概说 单糖分子中半缩醛可与另一分子单糖中羟基脱水而形成糖苷。这种糖苷因是两个单糖分子形成的,所以称为双糖。
1. 双糖的两种可能连接方式
(1) 通过两个单糖分子的半缩醛羟基脱去一分子水而相互连接成双糖:
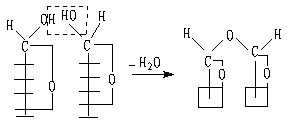
(2) 通过第一个单糖分子的半缩醛羟基与第二个分子中的醇羟基(如C-4的羟基)脱去一分子水而相互连接的双糖。

这样连接的苷叫1,4-苷键
3. 非还原性和还原性双糖
① 非还原性双糖 :通过两个半缩羟基而形成的双糖,分子中不能由环式转变成开链的醛式。这种双糖不能成脎,没有变旋现象,也没有还原性,如蔗糖。
② 还原性双糖:在双糖连接中,只有一分子单糖用半缩醛羟基与另一单糖分子中的醇羟基相连,整个双糖分子中还有一个半缩醛羟基,在溶液中它可以变成醛式,有变旋现象。能生成脎,有还原性:如纤维二糖,乳糖和麦芽糖。
二 重要的双糖
1. 蔗糖(普通食用的白糖)
蔗糖水解后生成等量的D-(+)-葡萄糖和D-(-)-果糖,所以蔗糖是由一个分子D-(+)-葡萄糖和一分子D-(-)-果糖组成的。
蔗糖的结构经化学实验和X射线分析,结构为:蔗糖的结构表示如下:
 α-D-葡萄糖-1,2-β-D果糖
α-D-葡萄糖-1,2-β-D果糖

 β-型
β-型
1953年,经全合成之后,才最后确定,蔗糖中葡萄糖的C1是α型,而果糖的C2是β型。
 基糖
基糖
2. 麦芽糖:
麦芽糖水解后生成两分子D-(+)-葡萄糖,因此推知它是由两分子D-(+)-葡萄糖组成的。
麦芽糖完全甲基化后再水解得一分子2,3,6-三甲基-D-(+)-葡萄糖和一分子2,3,4,6-四甲基-D-(+)-葡萄糖。所以它是由一分子D-(+)-葡萄糖半缩醛羟基和另一分子D-(+)-葡萄糖的C-4羟基失水而形成的.

α-1,4-麦芽糖 (缩醛)

2,3,4,6-四甲基-D-葡糖 2,3,6-三甲基-D-葡糖
1,4-苷键的构型是α-型还是β型,通常用两种酶来区别它 。
由麦芽糖酶水解生成两分子D-(+)-葡萄糖的为α-型。(半缩醛羟基为α-型)
由苦杏仁酶水解生成两分子D-(+)-葡萄糖的为 β- 型
麦芽糖能被麦芽糖酶水解,故为α-型。
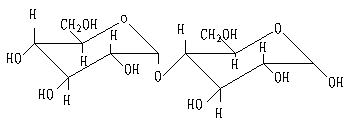
3. 纤维二糖
纤维二糖是纤维素的结构单位。纤维素部分水解也可得纤维二糖,它也是一个还原双糖。纤维二糖只能被苦杏仁酶水解,它的苷键是β型的。

β-型 纤维二糖
4. 乳糖:哺乳动物的乳中都含有乳糖


β-1,4-苷键 半缩醛羟基 D-(+)-半乳糖
(+)-乳糖是由一分子D-(+)-葡萄糖和一分子D-(+)-半乳糖结合起来的β-糖苷,乳糖是β-半乳糖苷
§5. 多 糖
纤维素和淀粉是D-葡萄糖的高聚体,这种多糖称为均聚糖。有的天然产多糖水解后得戊糖,己糖(醛糖或酮糖)或单糖的衍生物,如醛糖酸,氨基糖等,这种多糖为杂多糖。多糖与单糖、双糖及三糖、四糖等低聚糖在性质上有较大的区别。多糖没有还原性和变旋现象,也没有甜味。而且大多数难溶于水,有的能和水形成胶体溶液。
一 纤维素及其应用
1. 纤维素的结构:纤维素如用高浓度盐酸水解,可生成纤维二糖、纤维三糖、纤维四糖等,这说明纤维素是由多个纤维二糖聚合而成的高聚体。

纤维素都是由D-(+)-葡萄糖单体缩聚而成的一个直链高分子,而且都是以β-1,4-葡萄糖苷键的形式连接起来的,呈直线型。这是与淀粉的主要区别。
2. 人造纤维(再生纤维),把较短的棉纤维溶在适当溶剂内,然后把这个溶液压过极细的小孔,就可得到细长的丝状物质,干燥后就可供纺织用。这样改造的纤维素称为人造纤维。
(1)酮氨法:酮氨液是纤维素的良好溶剂,它使纤维素剧烈的润胀,然后溶解。纤维素的铜氨溶液在稀无机酸存在下,纤维素即由溶液中沉淀出来。工业上把纤维素的铜氨溶液过滤后经过细孔压入稀硫酸中,纤维素就成为细丝而再生出来。这样获得的人造纤维比天然丝还细两倍。
(2)胶丝法:纤维素里的羟基与氢氧化钠反应生成碱纤维素后,可以与二硫化碳发生
反应,生成纤维素黄原酸盐:

纤维素黄原酸盐加少量的水,可以得到粘稠的溶液,所以这个方法又称为粘液法。把这个溶液通过细孔,再进入稀硫酸内,黄原酸盐就被分解变成细长丝状的纤维素。这样获得的人造纤维称为粘液丝。
(3)纤维素硝酸酯:
纤维素的硝酸酯俗称硝化纤维素或硝化棉。是由纤维素和硝酸反应制得的:

实际上纤维素分子中的三个羟基不可能都完全酯化。因此,硝化纤维素的酯化度常用含氮量来表示。纤维素的三个羟基都酯化后,理论上含氮量为14.4%,高氮硝化纤维素通常用来制造火药,低氮硝化纤维素常用来制造塑料、喷漆等。
(4)醋酸纤维:纤维素用乙酐乙酰基化后得纤维素乙酸酯,俗称醋酸纤维素。

醋酸纤维素比硝化纤维素的较大的优点,对光稳定、不燃烧,故在制造胶片等制品方面已逐渐代替了硝化纤维素。
(5)纤维素醚:
羧甲基纤维素是由一氯乙酸和碱纤维素作用的产物。(CMC)

羟甲基纤维素
纤维素中多少羟基参与反应,决定产品的性质。
它在造纸工业上可用作胶料,在纺织工业上可用作经纱上浆代替淀粉。
二 淀粉
淀粉是一种最重要的多糖,是人类的重要食物。淀粉是植物体中储存的养料,多存在于种子或块茎中,用淀粉酶水解可得麦芽糖,在酸的作用下,能将彻底水解为D-(+)-葡萄糖。淀粉是麦芽糖的高聚体。淀粉由直链淀粉和支链淀粉两部分组成。他们的比例随植物的品种而不同,同时在结构和性质上也有一定的区别。
1. 直链淀粉:在玉米、马铃薯的淀粉中,含量约占20~30%,能溶于热水而不呈糊状,分子量比支链淀粉小,主要是由D-葡萄糖的α-1,4-苷键聚合而成的链状化合物。所以叫直链淀粉。它的构象并不是伸开的一条链,而是卷曲盘旋呈螺旋状存在,每一圈螺旋均含六个葡萄糖单体。
螺旋的中心正适合碘粉子的大小(实际上碘以络离子I3-存在)。当碘陷入直链淀粉分子的孔隧中,就生成深蓝色络合物。
2. 支链淀粉(淀粉皮质)
支链淀粉大概是由大约20个D-葡萄糖单体用α-1,4-链连结起来的许多短链组成的,而在这些短链之间是用α-1,6-键互相连结起来的。(教材图19-6)

分子的主要部分由几千个葡萄糖单位通过α-1,4-苷键连结形成,而每隔大约25到30个葡萄糖残基的地方出现α-1,6苷键连接,因而构成了分支状。
淀粉分子中的葡萄糖单位也和纤维素一样,有游离的羟基,从而可转变成醚或酯。如羧甲基淀粉(膨胀率为200~300倍)可作为药片的解崩剂(放在水中药片即破裂)
在化学实验中常用碘和可溶性淀粉生成深蓝的反应。这反应的实质是直链淀粉的螺旋状圆柱刚好能容纳钻入并吸附成包含物。
3. 环糊精:用杆菌(Bacillus macenans)发酵可得环状淀粉称环糊精。环糊精是6~12个D-葡萄糖单位α-1,4-苷键连接成的环,其六、七、八聚体可一一分离出来。
由于环胡精中间有个空穴,可以包含适当大小的有机物而溶于水溶液中。环胡精的这个性质现已广泛应用于有机物的分离、合成和医药工业中,如:

可以认为六聚环淀粉包含了甲氧基苯,仅甲氧基与对位暴露在空穴的两侧,而使试剂只能进攻空穴的一侧,即对位。
三 糖原
糖原是动物体内的储备糖,就像淀粉是植物的储备糖一样,所以又称为动物淀粉。以肝脏和肌肉中含量最大,因而也叫肝糖。它的分子结构与支链淀粉相同,含有α-1,4和α-1,6苷键,但其中侧链较支链淀粉多、密和短。
从结构上讲,糖原和支链淀粉很相似。主要的区别是糖原中分支更密,在糖原中每隔8到10个葡萄糖残基就出现α-1,6-苷键。