第20章 杂环化合物
§1. 杂环化合物的分类和命名
一、杂环大体可分为:单杂环和稠杂环两类:
1. 分类:
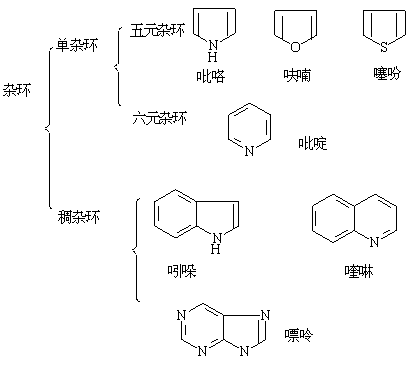
稠杂环是由苯环与单杂环或有两个以上单杂环稠并而成。
二、命名:
杂环的命名常用音译法,是按外文名称的音译,并加口字旁,表示为环状化合物。如杂环上有取代基时,取代基的位次从杂原子算起用1,2,3,4,5……(或可将杂原子旁的碳原子依次编为 α ,β, γ, δ …) 来编号。
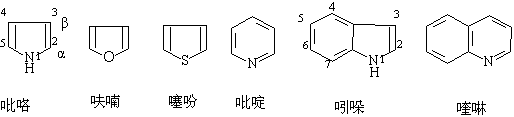
如杂环上不止一个杂原子时,则从O,S,N 顺序依次编号,编号时杂原子的位次数字之和应最小:
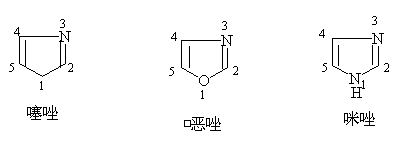
五元杂环中含有两个杂原子的体系叫唑(azole)
§2. 呋喃,噻吩,吡咯
含有一个杂原子的五元杂环单环体系:呋喃,噻吩,吡咯。
一、 呋喃,噻吩,吡咯的电子结构和光谱性质
电子结构:这三个杂环化合物中,碳原子和杂原子均以sp2杂化轨道互相连接成σ健,并且在一个平面上,每个碳原子及杂原子上均有一个p轨道互相平行,在碳原子的p轨道中有一个p电子,在杂原子的p轨道中有两个p电子,形成一个环形的封闭的π电子的共轭体系。这与休克尔的4n+2规则相符,因此这些杂环或多或少的具有与苯类似的性质,故称之为芳香杂环化合物。
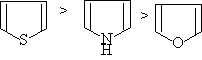
芳香性大小,试验结果表明:
光谱性质:IR: νc-H = 3077~3003cm-1,νN-H = 3500~3200 cm-1 (在非极性溶剂的稀溶液中,在3495 cm-1,有一尖峰。在浓溶液中则于3400 cm-1,有一尖峰。在浓和淡的中间浓度时,两种谱带都有),杂环C=C伸缩振动:1600~1300 cm-1 (有二至四个谱带)。
NMR:这些杂环化合物形成封闭的芳香封闭体系,与苯环类似,在核磁共振谱上,由于外磁场的作用而诱导出一个绕环转的环电流,此环电流可产生一个和外界磁场方向相反的感应磁场,在环外的质子,处在感应磁场回来的磁力线上,和外界磁场方向一致,在去屏蔽区域,故环上氢吸收峰移向低场。化学位移一般在7ppm左右。
呋喃:α-H δ=7.42ppm β-H δ=6.37ppm
噻吩:α-H δ=7.30ppm β-H δ=7.10ppm
吡咯:α-H δ=6.68ppm β-H δ=6.22ppm
二、呋喃,噻吩,吡咯的制备
1.玉米心,稻糠,花生壳,大麦壳,高粱秆等用稀硫酸处理得戊糖,戊糖失水得糠醛,再在400℃下加热,同时在催化剂ZnO,Cr2O3存在下,失去一氧化碳而得呋喃。
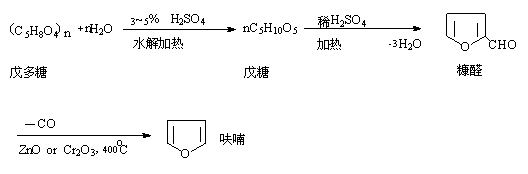
2.工业上制备噻吩是用丁烷,丁烯或丁二烯与硫磺混合,在600℃反应得到:
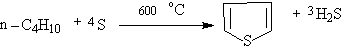
3.噻吩也可用琥珀酸钠盐与五硫化二磷一起加热反应制得:

4.帕尔——克诺尔(C.Paal—L.Knorr)合成法:
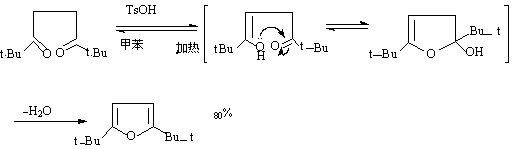
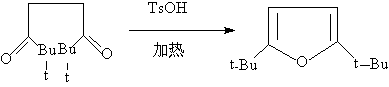
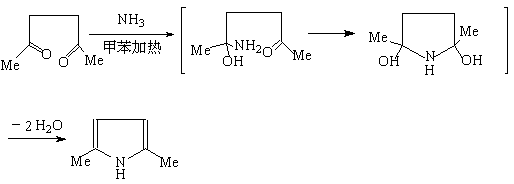
1,4—二羰基化合物常在无水的酸性条件下,得到呋喃及其衍生物。1,4—二羰基化合物与氨或硫化合物反应,可制备噻吩,吡咯及他们的衍生物,这个方法称为帕尔—克诺尔合成法:
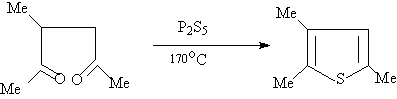
5.取代吡咯的另一个一般的合成法,称为克诺尔合成法,即用氨基酮与有α-亚甲基的酮进行缩合。例如用氨基酮酸酯与酮酸酯或1,3—二酮缩合,氨基酮酸脂由相应的β-羰基酯制得。
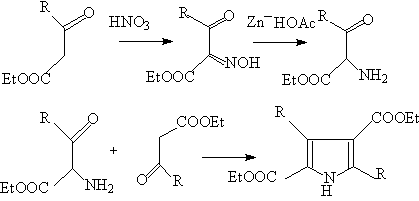
α—氨基酮 α—亚甲基酮
三、呋喃,噻吩,吡咯的反应
1.亲电取代反应:
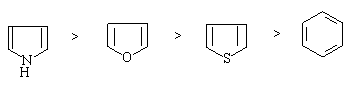
(1) 呋喃,噻吩,吡咯亲电取代活泼顺序
呋喃,噻吩,吡咯亲电取代反应很容易进行。这是由于环上五个原子共有六个π电子,故 π电子出现的几率密度比苯环大。换句话说,环上的杂原子有给电子的共轭效应,能使杂环活化。所以,在亲电取代反应中的速度比苯环快的多。亲电取代反应活泼顺序为:
杂原子给电子共轭效应愈强,环上电子云密度愈大,亲电取代愈易进行。
N 电负性3.0, O 电负性 3.5, S 电负性 2.4,N、O与碳在同一周期,S在第三周期,其p轨道与碳的p轨道重叠较小。
(2)亲电基团容易进入杂环的2,5 位(即α, α′位),若杂环的2,5位已有基团存在,则进入3位。
α位比较活泼的原因是因为在反应中形成的中间体正离子有三个共振式参与共振。如果在β位发生反应,形成的中间体正离子只有两个共振式参与共振,参与共振的共阵式愈多,杂化体愈稳定,故在α位发生反应的中间体正离子比较稳定,稳定的中间体正离子的过渡态能量低,反应速度快。因此亲电取代反应容易在α位发生。

 稳定
稳定
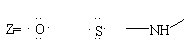
(3)呋喃,噻吩,吡咯,遇强酸及氧化剂很容易使环破坏,因此进行取代反应须在较温和的条件下进行。
(a)硝化
呋喃,噻吩,吡咯很容易被氧化,甚至也能被空气氧化。硝酸是强氧化剂,因此一般不用硝酸直接氧化。通常用比较温和的非质子的硝化试剂—硝酸乙酰酯进行硝化,反应还须在低温进行:
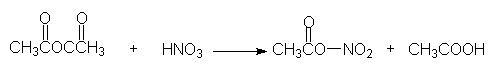
乙酐 乙酰基硝酸酯(硝酸乙酰酯)
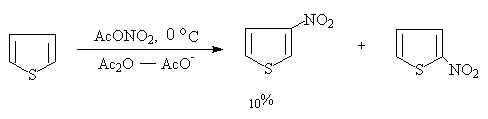
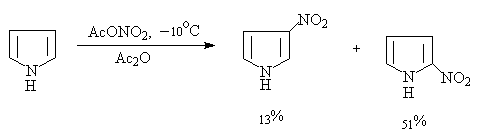
杂环亲电取代反应的活泼性越强,反应温度控制的越低。
呋喃比较特殊,在此反应中首先生成稳定的或不稳定的2,5—加成产物,然后加热或用吡啶除去乙酸,得硝化产物:
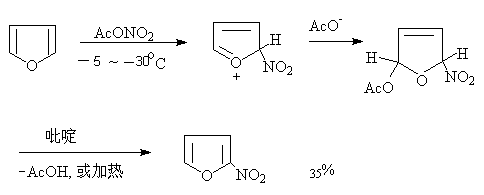
呋喃易生成2,5—加成物,与反应物的离域能大小有关。离域能大,过渡态已具有稳定的芳香族化合物的部分性质,能量也就较低,活化能小,容易发生亲电取代反应。呋喃的离域能较小(呋喃66.9kJ/mol,噻吩121.3 kJ/mol,吡咯87.8 kJ/mol)易与乙酰氧基负离子发生亲核加成反应,而吡咯具有较高的芳香性,因此,易于失去质子发生亲电取代反应。但必须注意到呋喃与大多数亲电试剂发生亲电取代反应,只有在强的亲核试剂存在时,才发生亲核加成反应(邢其毅等《基础有机化学》第二版874页)噻吩可以用一般的硝化试剂进行硝化,但反应非常猛烈。
(b)磺化
呋喃,噻吩,吡咯也需避免直接用硫酸进行磺化,常用温和的非质子磺化试剂,如用吡啶与三氧化硫加成物作为磺化剂进行反应:
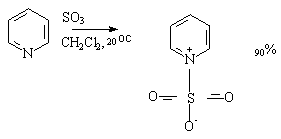
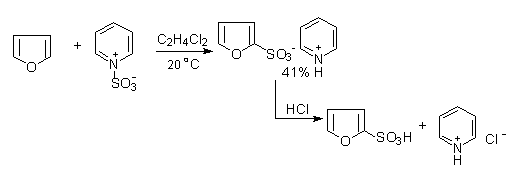
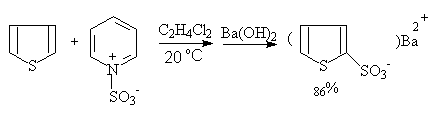
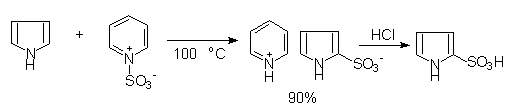 吡咯—2—磺酸
吡咯—2—磺酸
反应首先得到吡啶的磺酸盐,在用无机酸转为游离的磺酸。由于噻吩比较稳定(芳香性强),可以用硫酸直接进行磺化,但产率不如上述试剂所得到的高。从煤焦油中得到的苯通常含有少量的噻吩。可在室温下反复用硫酸提取,由于噻吩比苯容易磺化,磺化的噻吩溶于浓硫酸内,可以与苯分离。然后水解,将磺酸基去掉,可得到噻吩:
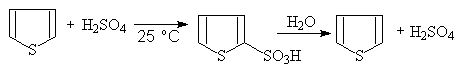
噻吩—2—磺酸69~76%(溶于浓H2SO4)
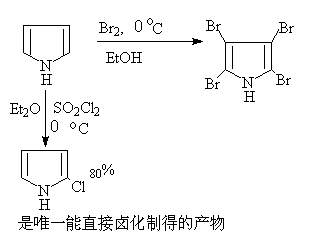
(c)卤化
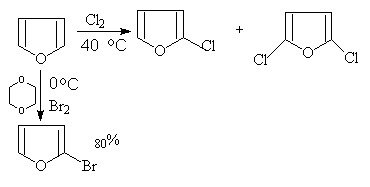
呋喃,噻吩在室温与氯或溴反应很强烈,得到多卤代的产物。如希望得到一氯代和一溴代的产物,须在温和的条件下(如用溶剂稀释)及低温下进行反应。不活泼的碘则须在催化剂作用下进行:
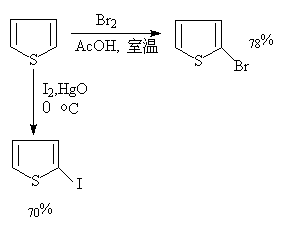
吡咯卤代常得到四卤化物。2—氯吡咯很不稳定,是唯一能直接卤化制得的2—卤吡咯。
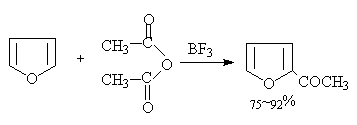
(d)傅氏酰基化
呋喃用酸酐或酰氯在傅氏催化剂作用下发生酰基化反应,酸酐如用三氟化硼做催化剂产率最高:
呋喃,吡咯,噻吩亲电取代反应小结:呋喃,吡咯遇强酸容易开环或产生聚合物。故所使用的亲电试剂一般比较温和。
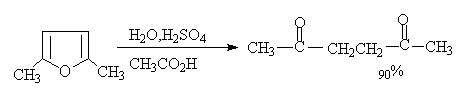
噻吩很稳定,与酸不发生上述反应。
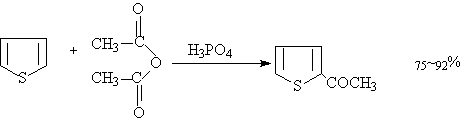
噻吩傅氏酰基化反应非常有用,但需要小心控制反应条件,如用无水三氯化铝,氯化锡等催化剂易于噻吩产生树脂状物质。必须将三氯化铝等先与酰化试剂反应生成活泼的亲电试剂,然后在与噻吩反应。
吡咯可用乙酸酐在150~200℃直接酰化:
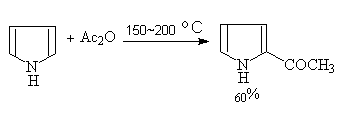
(e)傅氏烷基化
呋喃,噻吩,吡咯进行烷基化反应很难得到一烷基取代的产物。常得到混合的多烷基取代物。甚至不可避免的产生树脂状物质,因此用处不大。
2.加成反应:
(a) D-A反应
呋喃的离域能较小,芳香性较差,故环的稳定性较低。可以看作是1,3—二烯。具有共轭双烯的性质,可以发生双烯加成类型的反应:
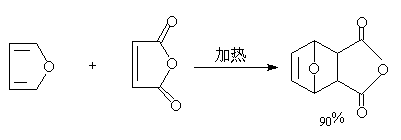
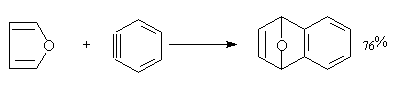
吡咯与顺丁烯酸酐不发生D—A反应,可能是氮原子的未共用电子对参加了共轭体系,典型的亲二烯试剂丁炔二酸(或酯)与之发生迈克尔加成反应。
吡咯能发生下列加成反应:

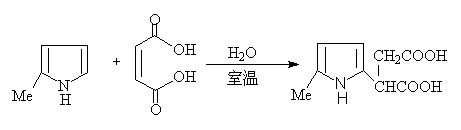
噻吩发生上述加成反应的倾向性很小。噻吩与乙炔的亲二烯试剂加成的研究较多,双烯加成产物通常不稳定,失硫而得苯的衍生物。
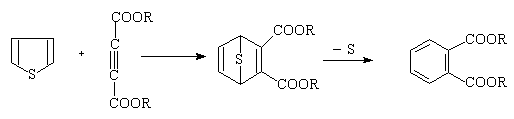
噻吩和吡咯中,由于硫和氮原子的电负性较小,芳香性较强,共轭二烯的性质较差。
(b)催化氢化反应
呋喃,噻吩,吡咯均可进行催化氢化反应,失去芳香特性而得到饱和杂环化合物。呋喃和吡咯可用一般催化剂还原,噻吩能使一般催化剂中毒,需使用特殊催化剂:
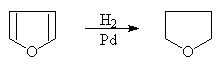
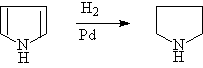
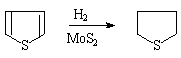
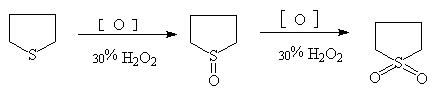
3.吡咯的弱碱性和弱酸性
从结构上看,吡咯是环状第二胺,但因氢原子上的未共用电子对参与了环的共轭体系,使氮原子上的电子出现的几率密度降低。减弱吸引H+的能力,故吡咯的碱性极弱,Kb=2.5×10-14,比苯胺弱的多,苯胺Kb=3.8×10-10.另一方面,吡咯氮原子上的氢原子却有极微弱的酸性,其酸性电离常数Ka=10-15, 较醇强而较酸弱。苯酚Ka=1.3×10-10,乙醇Ka≈10-18。故吡咯能与固体氢氧化钾加热成为钾盐:

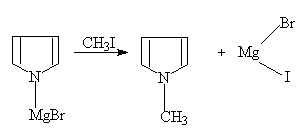
吡咯也能与格氏试剂作用放出烃(RH)而成吡咯卤化镁:
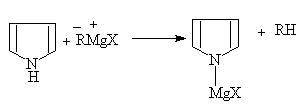
吡咯卤化镁
吡咯钾盐及吡咯卤化镁都可以用来合成吡咯衍生物。
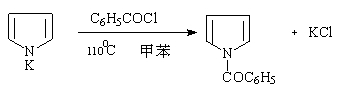
N—苯甲酰基吡咯 70%
4.吡咯的其它反应:吡咯的性质与酚很类似,可发生下列反应:
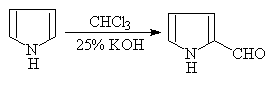
2—吡咯甲醛(瑞穆尔—梯曼反应)
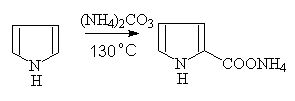
2—吡咯甲酸铵盐(柯尔柏反应)
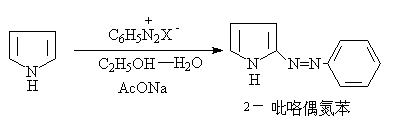
四、呋喃,吡咯的衍生物
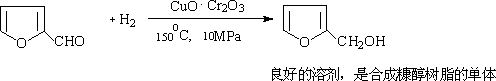
1.糠醛(α—呋喃甲醛):
糠醛是无色透明液体,糠醛在工业上由农副产物如甘蔗渣,花生壳,高粱秆,棉子壳等用稀酸加热蒸煮制取。
(1)糠醛是良好的溶剂:糠醛常用作精炼石油的溶剂,以溶解含硫物质及环烷等。还可以精制松香,脱除色素,溶解硝酸纤维等。
(2)催化加氢。
(3)氧化反应:


(4)歧化反应:(无α-H的醛)
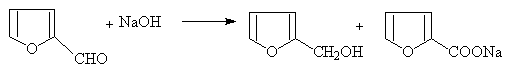
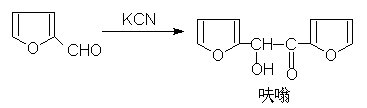
(5)安息香缩合:
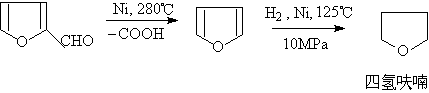
(6)合成四氢呋喃
2.卟吩化合物:四个吡咯环和四个次甲基交替相连组成的大环,叫卟吩 环。含卟吩环的化合物称卟啉化合物。
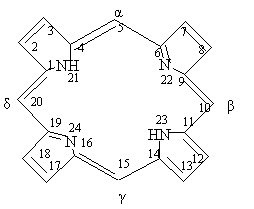
卟吩环碳上氢原子被取代及部分或全部取代后形成的化合物,叫做 卟啉。 卟吩化合物广泛分布于自然界,例如血红素和叶绿素。血红素存在于哺乳动物的红血球中,它与蛋白质合成为血红蛋白质。血红蛋白质的功能是运载氧气及二氧化碳。
叶绿素与蛋白质结合存在于植物的叶和绿色的茎中。植物光合作用时,叶绿素吸收太阳能转变为化学能,是植物进行光合作用时必需的催化剂。自然界的叶绿素不是一个单纯的化合物,而是由两种叶绿素组合而成,即蓝绿色的叶绿素a(熔点:117~120 ℃)和黄绿色的叶绿素b(熔点:120~130 ℃) ,两者的比例为:3a:4b,叶绿素 环中含镁。叶绿素a已经被合成(1960年)
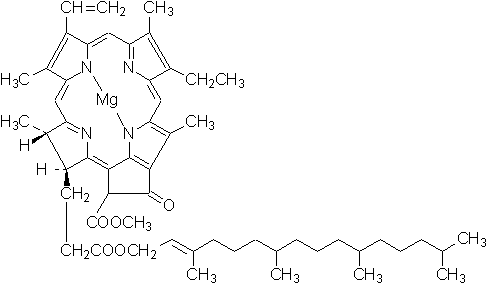
叶绿素 α 的结构
维生素B12,是含钴的类似卟啉环化合物。但其卟啉环在δ-位少一个碳原子。它具有强的医治贫血的功能。
§2.含有一个杂原子的五元杂环苯并体系
苯与呋喃,噻吩,吡咯共用两个碳原子而成的苯并体系,成为苯并呋喃,苯并噻吩,吲哚:
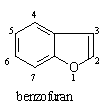
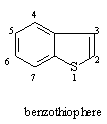

这三类化合物中,以吲哚环系比较重要,因此主要对吲哚环系进行一些介绍。吲哚本身为线状结晶,具有极臭的气味,但在其稀薄时则有香味,可以当作香料用。含吲哚环的生物碱广泛存在于植物中,如麦角碱,马钱子碱, 利血平等。植物生长调节剂β-吲哚乙酸,哺乳动物及人脑中思维活动的重要物质5—羟基色胺,植物染料靛蓝以及蛋白质组分的色氨酸都会有吲哚环。
1. 合成:费歇尔吲哚合成法是吲哚环系一个重要的广泛应用的合成方法,它是用苯腙在酸催化下加热重排消除一分子氨得到2—取代或3—取代吲哚衍生物。
现举例子如下:
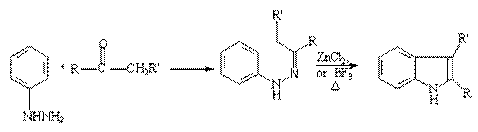

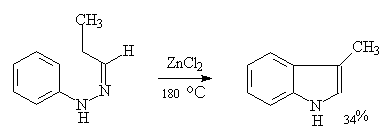
2.反应:五元杂环与苯并和后,仍具芳香性,但亲电取代反应的活泼性比未并和的五元杂环低,比苯高,故亲电取代反应在杂环上进行。这些环系遇浓硫酸易树脂化,需避免在浓硫酸存在下进行反应:
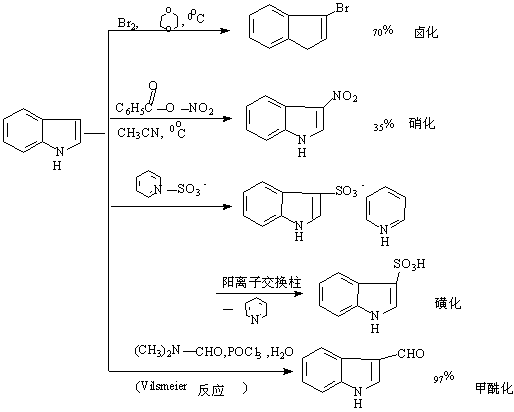
从上面反应可以看到,这些杂环化合物的亲电取代反应主要发生在3位。这与反应中间体正离子的稳定性有关。亲电试剂在C2位进攻,带有完整苯环的稳定共振式只有一个;而在C3位进攻,带有完整苯环的稳定共振式有两个:
在C2位进攻:
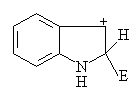
在C3位进攻:
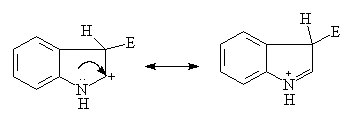
(八电子的带正电荷的氮)
参与的稳定的共振式视愈多,中间体正离子愈稳定。
§3. 含有两个杂原子的五元杂环单环体系
五元杂环中含有两个杂原子的体系叫唑(azole),根据杂原子在环中的位置不同,又可分为1,2—唑与1,3—唑两类。
一、命名:
环中有不同杂原子,按氧,硫,氮顺序编号。使杂原子编号最小:
1,2唑:
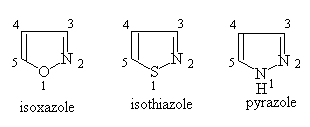
1,3唑:
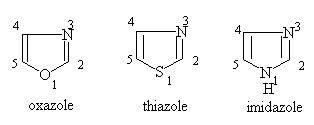
二、 性质
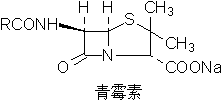
1.噻唑
一些重要的天然产物集合成药物含有噻唑结构,如:
2. 咪唑
它的碱性较噻唑强,3位上的氮原子能与氢离子结合,故与强酸生成稳定的盐。
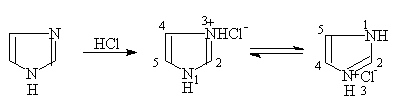
它也有微弱的酸性,像吡咯一样 〉NH上的氢原子可被碱金属原子置换而成盐。
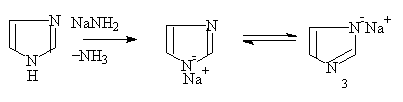
咪唑有互变异构现象,即 〉NH上的氢原子可以移至3位N原子上。
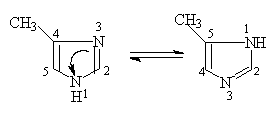
4—甲基咪唑 5—甲基咪唑
含咪环的物质广泛存在于自然界中,具有生理活性。由于含咪唑环的化合物具有突出的生理活性,有的已被用作杀菌剂。
§4 六元杂环化合物
一、嘧啶
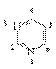
含有两个氮原子的六元杂环,嘧啶的衍生物广泛的存在于自然界。如核酸中含脲嘧啶、 胸腺嘧啶、 胞嘧啶。
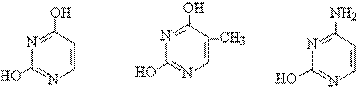
脲嘧啶、 胸腺嘧啶、 胞嘧啶
另外,VB1合成的磺胺嘧啶物也含有嘧啶环这种结构。
二、嘌呤
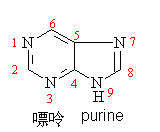
嘌呤可看作是有一个嘧啶环和一个咪唑环共用两个碳原子稠并而成,它是无色结晶,熔点216~217℃, 易溶于水,其水溶液呈中性,但却能与酸或碱共成盐。
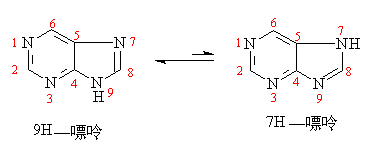
嘌呤是两个互变异构体形成的平衡体系,平衡主要在9H-嘌呤一边:
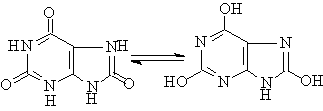
嘌呤的衍生物广泛存在于动植物体中。
1.尿酸:存在于鸟类及爬虫类的排泄物中。
2黄嘌呤:存在于茶叶及动植物组织和人尿中。
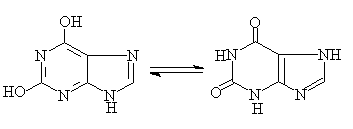
3.咖啡碱,茶碱和可可碱:都是黄嘌呤的甲基衍生物。存在于茶叶,咖啡,和可可中,他们有兴奋中枢作用。
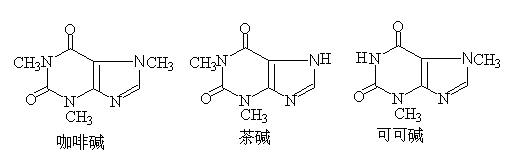
4.腺嘌呤和鸟嘌呤: 是决定生命的遗传及合成蛋白质的物质。核酸中存在的嘌呤环系是腺嘌呤与鸟嘌呤。
§5 生物碱
生物碱是一类存在于生物体内,对任何动物有强烈生理作用的含氮碱性有机化合物,如烟叶中的主要生物碱组分是
尼古丁( 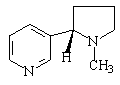 )。生物碱在植物体内常于有机酸(果酸,柠檬酸,草酸,琥珀酸,醋酸,丙酸等)结合成盐而存在,也有和无机酸(磷酸,硫酸,盐酸)结合的。中草药治病有效成分有生物碱,苷等。生物碱的研究促进有机合成药物的发展,为合成新药提供线索,如古柯碱化学的研究导致局部麻醉剂普鲁卡因的合成。
)。生物碱在植物体内常于有机酸(果酸,柠檬酸,草酸,琥珀酸,醋酸,丙酸等)结合成盐而存在,也有和无机酸(磷酸,硫酸,盐酸)结合的。中草药治病有效成分有生物碱,苷等。生物碱的研究促进有机合成药物的发展,为合成新药提供线索,如古柯碱化学的研究导致局部麻醉剂普鲁卡因的合成。
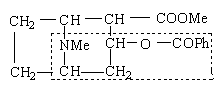 古柯碱
古柯碱
古柯碱具有局部麻醉的效能,上面结构式中虚线部分代表有效部分。但古柯碱毒性大,具有易产生毒瘾等缺点,于是进行代用品的研究,药学家合成出许多比古柯碱分子简单而更有效的麻醉药,普鲁卡因等,它是良好的局部麻醉药。

同时归纳出局部麻醉药具有下式的基本结构:
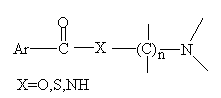
—. 生物碱的一般性质
1.游离生物碱物理性质:
一般是无色固体结晶,有色的很少(黄连素黄色),液体也很少(烟碱为液体),有苦味。分子中含有手征碳原子,具有旋光作用,如天然烟碱(尼古丁)是左旋的。能溶于氯仿,乙醇,醚等有机溶剂,多半不溶或难溶于水。能与无机酸或有机酸结合成盐。这种盐一般易溶于水。
2.化学性质:
(1)生物碱的沉淀反应:生物碱的中性或酸性水溶液与一些试剂(如10%苦味酸)能发生沉淀。
(2)生物碱的颜色反应:生物碱与一些浓酸能呈现出各种颜色,其颜色随各种生物碱而各有特征。
二、 生物碱结构的化学测定
化学方法通常是先测定其分子式和所含官能团,然后通过降解反应使之成为一些结构的碎片,推测出可能的结构式。最后用可靠的合成方法加以验证。