第十二章 醛 酮
醛酮又含有羰基,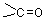 ,在醛分子中羰基于一个氢原子和一个烃基相连(甲醛例外,是和两个氢相连),其通式为:RCH=O,简写作RCHO,-CHO 叫作醛基;
,在醛分子中羰基于一个氢原子和一个烃基相连(甲醛例外,是和两个氢相连),其通式为:RCH=O,简写作RCHO,-CHO 叫作醛基;
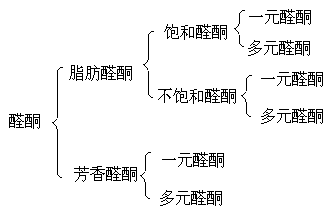
在酮分子中羰基与两个烃基相连,其通式为: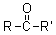 ,其羰基又叫作酮基。醛酮可分为:
,其羰基又叫作酮基。醛酮可分为:
§1. 一元醛酮的结构、命名和物理性质
一、醛和酮的结构
(自学)
二、 命名
1. 醛、酮的系统命名
以包含羰基的最长碳链为主链,看作母体。从靠近羰基的一端开始,依次标明碳原子的位次。在醛分子中,醛基总是处于第一位,命名时可不加以标明。酮分子中羰基的位次(除丙酮、丁酮外)必须标明,因为它有位置异构体。
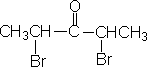
醛、酮碳原子的位次,除用1,2,3,4,…表示外,有时也用α,β,γ…希腊字母表示。α是指官能团羰基旁第一个位置,β是指第二个位置…。
|
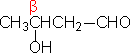
|
|
|
β-羟基丁醛 |
α,α’-二溴-3-戊酮 |
酮中一边用α,β,γ…,另一边用α’ β’ γ’…。
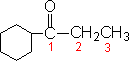
ⅰ 含醛基、酮基的碳链上的氢被芳环或环烷基取代,就把芳环或环烷基当作主链上的取代基看待:
|

|
|
|
2-苯丙醛 |
1-环己基-1-丙酮 |
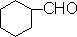
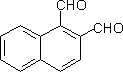
ⅱ 醛基与芳环、脂环或杂环上的碳原子直接相连时,它们的命名可在相应的环系名称之后加-“醛”字。
|
|
|
|
环己醛 |
1,2-萘二醛 |
ⅲ 当芳环上不但连有醛基,而且连有其它优先主官能团时,则醛基可视作取代基,用甲酰基做词头来命名。
|

|
|
4-甲酰基苯甲酸 |
2. 酮还有另一种命名法
根据羰基所连的两个烃基名来命名,把较简单的烃基名称放在前面,较复杂的烃基名称放在后面,最后加“酮”字。
|
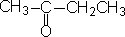
|
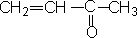
|
|
甲乙酮(丁酮) |
甲基乙烯基酮(丁烯酮) |
 后面是母体
后面是母体
如含有两个以上羰基的化合物,可用二醛、二酮等,醛作取代基时,可用词头“甲酰基”或“氧代”表示;酮作取代时,用词头“氧代”表示。
|
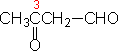
|
|
|
3-氧代戊醛 (3-oxopentanal) |
2,4-戊二酮 (2,4-pentanedione) |
英文 羰基做取代基时用“oxo”(氧代)表示
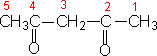
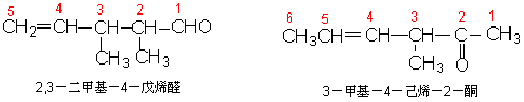
不饱和醛、酮的命名是从靠近羰基一端给主链编号。
|
|
|
|
三、 醛、酮的物理性质
1.物理性质
除甲醛是气体外,十二个碳原子以下的醛、酮都是液体,高级的醛、酮是固体。低级醛常带有刺鼻的气味,中级醛则有花果香,所以C8~C13的醛常用于香料工业。低级酮有清爽味,中级酮也有香味。
羰基中,碳和氧以双键相结合,碳原子用三个sp2杂化轨道形成三个σ键,其中一个是和氧形成一个σ键,这三个键在同一个平面上。碳原子剩下来的一个p轨道和氧的一个p轨道与这三个σ键所形成的平面垂直,彼此重叠形成一个π键
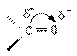
由于氧的电负性吸引电子的能力很强,所以羰基是一个极性基团,具有一个偶极矩,负极向氧一面,正极朝向碳的一面。
由于羰基的偶极矩,增加了分子间吸引,所以它们的沸点与分子量相近的烷烃相比较,增高50℃以上。但因为醛酮分子间不能形成氢键,故其沸点则低于相应的醇。
羰基氧能和水分子形成氢键,故低级醛、酮溶于水。
2. 光谱性质
IR: 醛 C=O 伸缩在1725cm-1附近,有强吸收峰。(共轭作用使吸收波数减少)
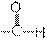 中C-H吸收在2720cm-1附近有尖峰。 中C-H吸收在2720cm-1附近有尖峰。
酮 C=O 伸缩在1715cm-1附近有强吸收峰。(共轭作用使吸收波数减小)
|
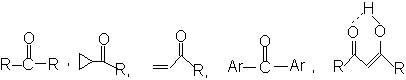
|
|
1715 1695 1675 1665 1640 cm-1 |
在环酮中,环张力使吸收波数增加。
|
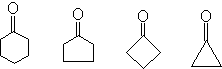
|
|
1715 1745 1780 1815 cm-1 |
NMR: 醛基上的H δ=10ppm(而碳碳双键上的H约在δ=5ppm)这可能是  的各向异性效应和羰基的吸电子效应减低了H周围电子密度所致。 的各向异性效应和羰基的吸电子效应减低了H周围电子密度所致。
UV: 提供有关羰基和C=C双键共轭的信息,若醛、酮为共轭体系,则在近紫外或可见区出现强吸收带(K带)-共轭带(Konjuierte,共轭的,德文) 如:
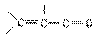
K带:λmax 215-250nm(εmax 10000-20000) π→π*
R带: (基团型的,Radiralartig 德文) λmax 300-350nm(εmax 10-102) n-π﹡
§2.醛酮与亲核试剂的加成反应 |
|
从醛酮的羰基结构可知,由于氧的诱导效应,使和它直接相连的碳原子带有电正性,由于这种关系,碳原子很容易和一系列的亲核试剂发生反应,氧原子在亲核试剂加入后,可以和一个亲电的部分结合。一般的讲,带负电荷的氧(电负性大,能容纳负电荷)比带正电荷的碳稳定。因此,羰基反应可以看作是首先由亲核试剂和碳原子结合而引起的。
1. 加水
醛酮在水溶液中生成水合物:
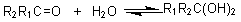
在一般情况下产物不稳定,容易脱水而生成醛酮。但有些1,1-二醇是很稳定的化合物。
⑴. 结构对平衡位置的影响
羰基是极化的,碳原子带部分正电荷,羰基上如有烷基或芳基,由于超共轭或共轭效应的影响,使羰基碳上的正电荷得到分散,与甲基是碳正离子稳定性提高相似。化合物的稳定性也相应提高,是水合平衡中水合物的含量降低。所以,甲醛、乙醛和丙酮的稳定性次序为:
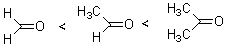
它们的水合物稳定次序为:
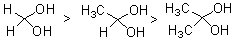
甲醛在水溶液中完全转变成水合物,乙醛约有56%,而丙酮在水溶液中水合物的含量极低。
如结构因素是水合物的稳定性相对提高,则是水合平衡位置偏向右边,例如:
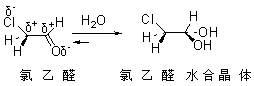
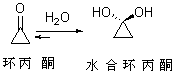
 三酮分子中,三个带正电荷的羰基碳原子连接在一起,由于正电荷互相排斥,分子的位能升高,因此,
三酮分子中,三个带正电荷的羰基碳原子连接在一起,由于正电荷互相排斥,分子的位能升高,因此, 三酮是一个不稳定的化合物。中间的痰迹变成水合物以后电荷间斥力减小,还能生成分子内氢键,因此,水合平衡偏向水合物一边:
三酮是一个不稳定的化合物。中间的痰迹变成水合物以后电荷间斥力减小,还能生成分子内氢键,因此,水合平衡偏向水合物一边:

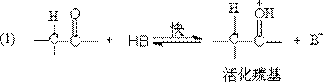
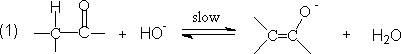
⑵ 酸和碱的催化作用
在碱溶液中进攻试剂是HO-离子:

在酸存在下是羰基氧线很快接受一个质子,质子化后再与生成水合物:
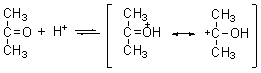
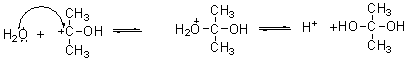
2. 加醇
① 醛酮加一分子醇生成半缩醛或半缩酮(酸和碱都可以起催化作用):

② 醛酮在酸催化作用下和两分子醇反应生成缩醛或缩酮:

③ 缩醛和缩酮对碱稳定,在酸性水溶液中水解成醛酮,在有机合成上常用来保护羰基:
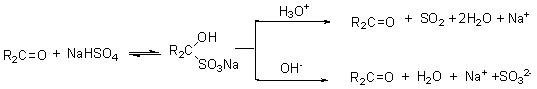
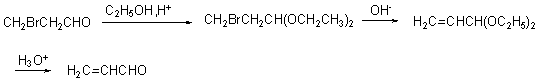 3. 加亚硫酸氢钠
3. 加亚硫酸氢钠
过饱和亚硫酸氢钠水溶液中与醛酮一起摇动,有白色晶体析出,生成的亚硫酸氢钠加成物容易分离,也容易变回原来的醛酮,因此常用来醛酮的分离提纯:
4.与羟胺、苯肼和氨基脲反应(可逆的)
① 与羟胺反应:
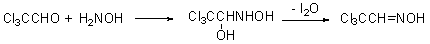
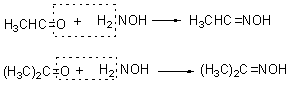
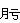 与稀盐酸一起加热,水解生成原来的醛酮,利用这个性质可以用来提纯醛酮:
与稀盐酸一起加热,水解生成原来的醛酮,利用这个性质可以用来提纯醛酮:
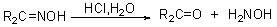
反应历程:

② 与苯肼和氨基尿反应分别生成苯腙和缩氨尿:
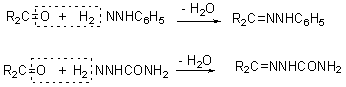
5. 与伯胺反应:
醛酮与伯胺反应生成亚胺(含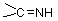 结构的化合物 )
结构的化合物 )

R和R’ 都是脂肪烃基的亚胺不稳定,其中有一个为芳基的亚胺是稳定的晶体,由于平衡偏向右边,制备很容易。之类化合物叫作席夫碱(Schiff’s base):
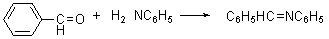
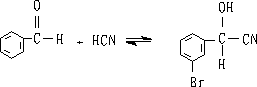
6. 氢氰酸
醛酮与氢氰酸反应生成氰醇:
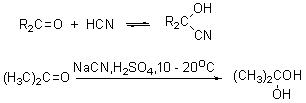
醛、脂肪族甲基酮和环酮(8个碳以下)都可发生此反应。合成“有机玻璃”的原料就是通过丙酮和HCN作用制得的.
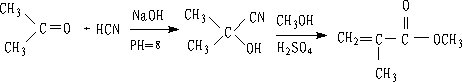
丙酮羟氢(78%) α-甲基丙烯酸甲酯(90%) (有机玻璃单体)
反应机理:
以HCN与丙酮反应为例,探索醛、酮的亲核加成机理。
这里pH值的大小很重要,可偏碱性一些。丙酮单独和HCN作用时,就是3-4h,亦只有一半起反应,若加一滴KOH溶液,反应在两分钟内完成。加酸会使反应减慢。在大量酸的存在下,放几个星期也不起反应。从这些现象我们可以推测,醛、酮加HCN反应有下面机理:
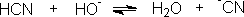
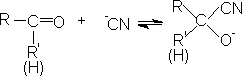
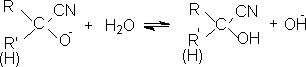
HCN是一个弱酸,不易离解成-CN,加碱有利于-CN的生成。
加酸要使-CN变成HCN,这样-CN离子的浓度降低,不利于反应的进行。可是在氰醇生成后,用蒸馏方法分离它之前,必须将反应中的碱用酸除去,不然它要使反应向左移动,因为上面这些反应都是可逆的,氰醇会逐渐分解,成为醛、酮和HCN。相反,在酸存在下,氰醇是稳定的,可以蒸馏而不致分解。
HCN挥发性较大(b.p. 26.5℃),有剧毒,使用不便。故目前常将醛、酮和KCN或NaCN的水溶液混合,在加入无机酸,使氢氰酸一生成,就与醛、酮作用。(操作需在通风厨中进行)
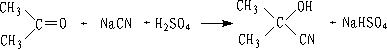
另外,我们还可以先将醛、酮变成亚硫酸氢钠加成物,然后再用等当量的氰化钠处理,这样制取氰醇就比较安全。
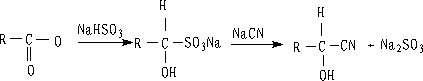
7. 与格氏试剂的加成反应:
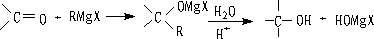
是制备结构复杂的醇的重要方法。在酸性条件下进行水解(如稀盐酸或稀硫酸)以便使产生的碱或卤化镁转变为易溶于水的镁盐。对遇酸极易脱水的醇最好用NH4Cl溶液进行水解。
§3 .羰基加成反应的立体化学和影响因素
一、 羰基加成反应的立体化学
(1) 对手性脂肪醛酮的加成:
克拉姆(D.J.Cram )定则:进攻试剂与羰基加成的第一步就是其金属先与羰基氧原子配位,加大了氧原子一端的体积,使之定位于M与S之间,即反应的优势构象。加成的第二步即向最小原子(或基团)的一侧进攻最为有利。
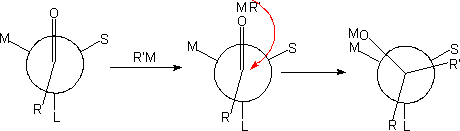
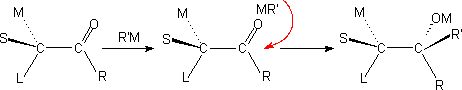

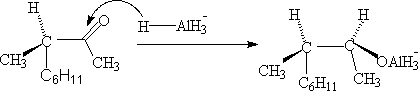
上述原则,适合于速度控制(动力学控制)
(2) 反应物为脂环酮的加成:
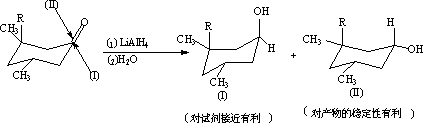
总的来说,环上取代基与试剂的体积愈大,按(I)方式就愈多。如:
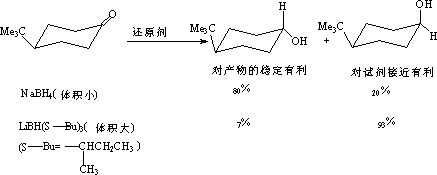
(3) 对于位阻大的脂环酮,反应利于进攻羰基位阻小的方向。
3. 梅尔魏因-庞多夫-维尔来(Meerwein-Ponndirf-Verley)羰基还原法。
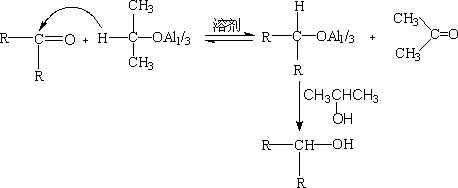
异丙醇铝是一个选择性很高的醛酮还原剂,它把负氢离子转移给醛或酮,而本身氧化成丙酮。随着反应进行,把丙酮蒸出来,使反应 X向产物方向进行。
在反应中加入过量的异丙醇,新生的醇铝可以和异丙醇交换,再生成异丙醇铝,进行还原。因此,只要使用催化量的异丙醇铝就可以完成反应。
此反应的优点:还原不饱和羰基化合物时,特别顺利,不影响C=C, -NO2, -COOR.


历程:
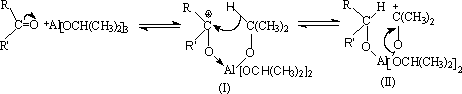

异丙醇铝与被还原的醛或酮的羰基生成配位键得(I)。(I)发生分子内氢负离子移位,得到一个新的醇酮络合物(II).(II)进一步裂解为丙酮和(III)。(III)被无机酸分解得醇(或被异丙醇交换)。若用异丁醇铝,可形成。
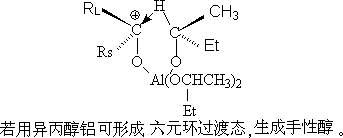
二、影响因素
1.醛、酮的烃基立体效应的影响
随取代醛酮的烃基的增大,亲核加成速度减小,平衡常数减少。如:
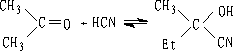 K=38
K=38
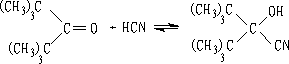 K<<1
K<<1
亲核加成反应速度次序为:
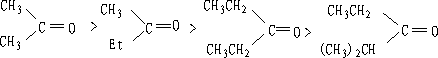
原因:由于高级烷基产生了立体位阻,羰基碳不易被亲核试剂进攻,因而减低了它的反应性能。
2. 醛、酮的烃基电子效应的影响
ⅰ 当羰基连有给电子取代基时,增加了羰基碳原子的电子云密度,电正性减小,使亲核试剂不易加成。
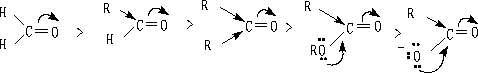
ⅱ 羰基与苯环等组成共轭体系,羰基碳的安定性增加,反应性能减小。
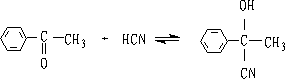 K=0.77(小于1)
K=0.77(小于1)
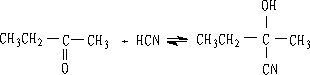 K=38
K=38
ⅲ 随醛酮的烃基吸电子性增加,羰基碳电正性增加,反应活性增大,平衡常数增大。
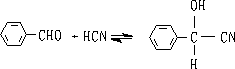 KC1=210
KC1=210
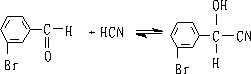 KC2=530
KC2=530
KC1<<KC2
 KC=530
KC=530
因为R,R/ 吸电子使羰基碳原子的亲电性增加,更易与亲核试剂结合。平衡(向右移动)常数增大。
§4.α-H 的酸性
1. 醛酮的互变异构
在溶液中,有α-H的醛酮是以酮式和稀醇式平衡而存在的。
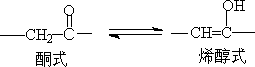
不同结构的醛酮,酮式和烯醇式含量不同,它取决于醛酮的结构。
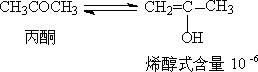
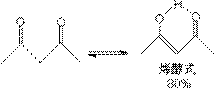
烯醇式的双键与其他不饱和基团共轭时,使烯醇式稳定,在平衡体系中烯醇式增多。
烯醇式变为酮式时,氢向烯醇式平面前方转移和向后方转移,所得酮式的α碳构型不同。
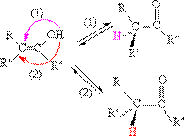
问题:解释在碱性溶液中,(+)-苯基仲丁基酮发生外消旋化的原因。莫里森《有机化学》:588页。
烯醇既是烯,又是醇,其本身就有两个反应中心。
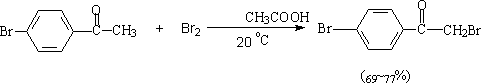
2. 卤代反应
在酸、碱催化下,卤素可以使醛、酮的α位卤化。
[1]酸催化卤化
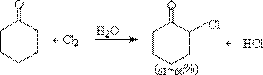
所谓酸催化,通常不加酸,因为只要反应一开始,就产生酸,此酸就可自动发生催化反应,因此在反应还没有开始时,有一个诱导阶段,一旦有一点酸产生,反应就很快进行。可能的机理是:首先羰基质子化,然后通过烯醇式进行卤化。

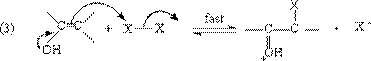

对于不对称酮,卤化反应的优先次序是:
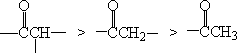
这是因为α碳上取代基愈多,超共轭效应愈大,形成的烯醇愈稳定,因此,这个碳上的氢就易于离开而进行卤化反应。
酸催化卤化反应可以控制在一元、二元、三元等阶段,在合成反应中,大多希望控制在一元阶段。能控制的原因是一元卤化后,由于引人的卤原子的吸电子效应,使碳基氧上电子云密度降低,再质子化形成烯醇要比未卤代时困难一些,因此小心控制卤素可以使反应停留在一元阶段。因此,控制卤素的用量,就可以控制反应产物。
[2]碱催化卤化
碱催化过程如下:
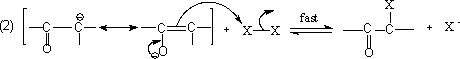
反应首先是HO– 夺去质子,形成烯醇负离子,再与卤素发生反应,得α-卤代酮,不对称酮α氢的反应性是:
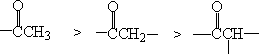
因为-CH3上的氢酸性大,易被OH- 夺取。
参考书:
[美]F.A.凯里,R.J.森德伯格著,王积涛译《高等有机化学》B卷 P78;
邢其毅等《基础有机化学》上册,2版,高等教育出版社,1993. P488。
酸、碱催化卤化反应的差别:
a. 在酸催化条件下,使用一当量的卤素,可以以较好产率制备单卤代酮。
b.在碱催化反应中,碱催化卤化不易制备单卤代酮。甲基酮在碱催化下,给出三卤代酮:
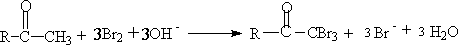
这是因为,当一元卤化后,由于卤原子的吸电子效应,使卤原子所在碳上的氢,酸性比未被卤原子取代前更大,因此第二个氢更容易被OH- 夺取并进行卤化。同理第三个氢比第二个氢更易被OH- 夺取。因此只要有一个氢被卤化,第二、第三个氢均被卤化,即反应不停留在一元阶段,一直到这个碳上的氢完全被取代为止。
三卤代酮进一步和OH-离子反应,给出羧酸盐和卤仿。整个反应叫卤仿反应(haloform reaction)。

裂解机理:
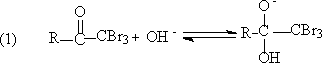


参考书:
[美]H.O.House著,花文廷等译《现代合成反应》p362页。
Andrew Streitwieser,Jr.clayton H.Heathcock.Introduction to Organic Chemistry. Second.Edition.p375-377。
从反应过程可以看出,有CH3CO-可以发生卤化反应。次卤酸钠(NaOX)是一种氧化剂,被NaOX氧化成
CH3CO-结构的一些化合物,也能发生卤仿反应。
由于碘仿是黄色晶体,水溶性小,易于析出,有特殊气味,所以常用碘仿反应来鉴定化合物是否有CH3CO-,
CH3CH(OH)-的结构。
次卤酸盐不氧化双键,在合成上,可由不饱和甲基酮,合成相应的不饱和酸:

3. 羟醛缩合反应
羟缩合反应(aldol condensation),是一分子醛或酮,在碱或酸的作用下,形成碳负离子,此碳负离子与另一分子醛或酮的碳基发生亲核加成反应,形成β羟基醛或酮,β-羟基醛或酮有的在反应时就失水,有的在强酸或强碱作用下失水,生成α,β-不饱和醛、酮,这一反应称羟醛缩合,是合成α,β-不饱和醛和酮的一个很好方法。
反应机理:
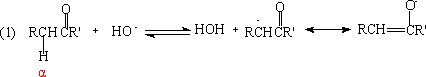
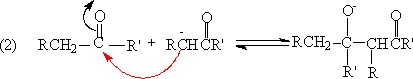
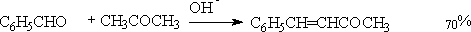
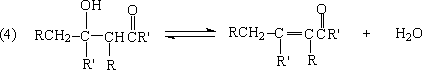
一般来说,碱或酸催化的羟基缩合加成阶段很容易逆转。许多脂肪族的酮,热力学上对第二步反应(2)是不利的,平衡大大偏于反应物方面,往往需要用特殊的方法,使
反应朝右进行。反应(4)也是可逆的,在比较强烈的条件下,有利于失水反应,这时尽管对(2)反应不利,但也可以把反应通过(4)完全移向右方。
A.相同醛的羟醛缩合
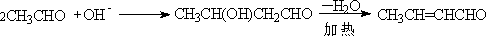
B.交错缩合:
有α-H的两种醛缩合可产生混合物。但选用一种无α-H的醛和一种带α-H的醛进行交错缩合,则有合成价值。
① 芳醛与脂肪酮
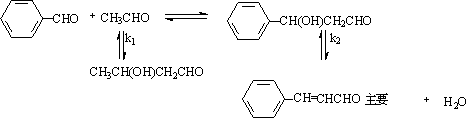
k2>k1,容易去水生成α,β不饱和醛。
②甲醛与脂肪醛:
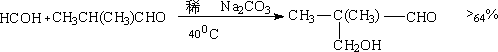
③ 芳醛与对称脂肪酮:
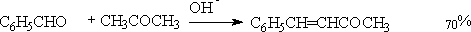
④芳醛与不对称酮:
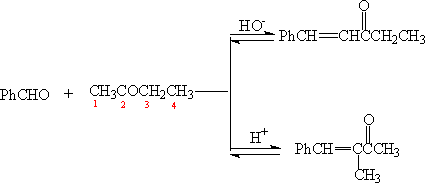
一般来说,碱催化有利于直链式缩合产物的生成,酸催化有利于支链产物的生成。
解释:
在碱性条件下,因丁酮中C-1甲基的质子酸性大,位阻小,易于碱结合,使C-1形成碳负离子,由碳负离子转为烯醇负离子,受动力学控制,得到取代基最少的烯醇负离子。
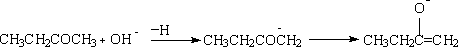
在酸性条件下,H+与酮先质子化形成盐,然后发生电子转移,并失去α- H ,得较稳定的烯醇式,受热力学控制,得取代较多的烯醇式
参考书:
邢其毅等《基础有机化学》(第二版),上册,高等教育出版社(2000),p484
⑤
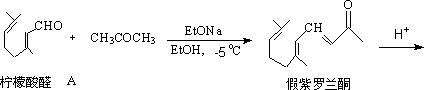
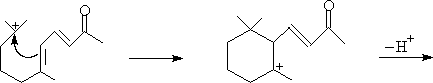
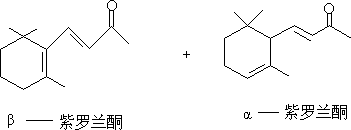
C. 二酮化合物分子内羟酮缩合。
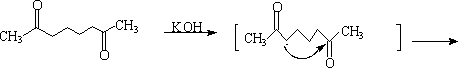
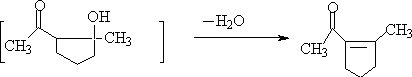
容易得稳定的五、六元环α,β-不饱和羰基化合物。
4. 歧化反应(cannizzaro反应)
没有α- H的醛与浓强碱共热。
(1)分子间的cannizzaro反应:

由于甲醛在醛类中还原性能最强,所以总是自身被氧化成甲酸,苯甲醛被还原为苯甲醇。 机理:
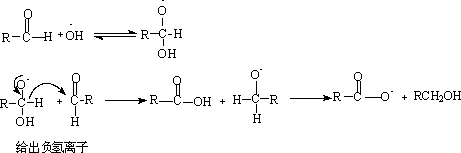
歧化反应在生产上及生理上的氧化还原反应中都很重要。工业上利用甲醛这一性质和乙醛进行混合的醇醛缩合反应制备季戊四醇C(CH2OH)4。
(2) 分子内的cannizzaro反应
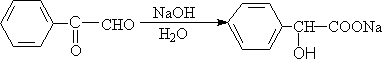
机理:
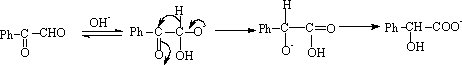
5. 安息香缩合
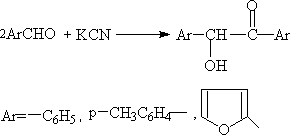
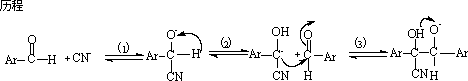
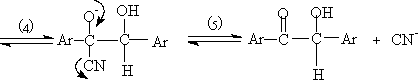
在芳香醛的醛基的邻或对位有强吸电子的原子团(如 -NO2)或强排斥电子的原子团(如-OH, -OCH3, -N(CH3)2)时,则这些醛不能自身发生安息香缩合。
解释:这是由于强排斥电子的原子团使羰基的碳原子的正电荷减低,不利于碳负离子对它进攻。即妨碍(3)步的发生。同样强吸引电子的原子团亦妨碍(3)步的进行。这是因为CN-负离子和醛加成后形成的负离子由于硝基强吸引电子效应,使碳负离子的电子密度降低,其亲核性减弱,使此碳离子不能和另一醛分子的羰基加成。
6. 醛酮的其他缩合反应
(1)Knoevenagel反应(柯诺瓦诺格反应)-活泼亚甲基的反应
醛或酮和具有通式 Z-CH2- Z’ 或Z -CHR-Z’含活泼氢化合物的缩合作用,称为Knoevenagel缩合反应。Z和Z’是吸电子基团。其他含活泼氢的化合物也能发生此反应。如:CHCl3、端基炔、戊二稀等。

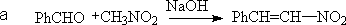

(2) Perkin反应
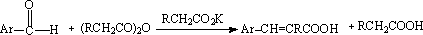
芳香醛与酸酐在同酸酐相应的钠或钾盐的存在下的缩合作用,称为Perkin反应。当酸酐具有两个α氢原子时,则常发生失水反应。此反应适用于芳香醛。
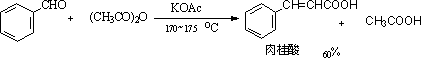
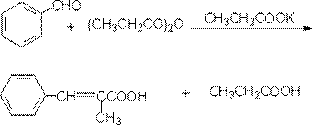
(3)Mannich(曼尼西)反应——胺甲基化反应
利用甲醛和含有活泼α-氢的醛酮进行反应,即全部的活泼氢都将进行羟甲基化。如可在活泼甲基上只引入一个碳原子,经常用活泼甲基化合物和甲醛及一个二级胺同时反应,这样就把一个活泼α-氢用一个胺甲基代替,因此,称为胺甲基化反应(Mannich reaction)
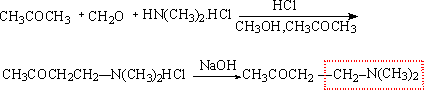
这个反应一般是在水、醇或醋酸溶液中进行。
酚的对位或邻位, 吲哚的3位,也可发生胺甲基化反应。曼氏碱制成季铵盐,加热,可生成α,β不饱和酮,是重要的有机合成中间体。
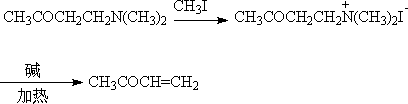
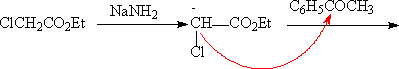
(4)Darzen反应(达森反应)-环氧脂的合成
醛酮在强碱的作用下(如醇钠,氨钠等)和一个α-卤代羧酸酯反应,生成一个α,β环氧羧酸酯。
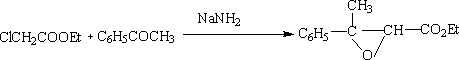
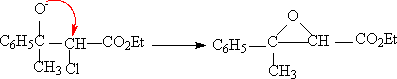
(5)* 醛酮与芳胺、酚的缩合
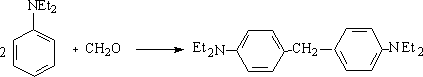

§5.醛酮的氧化和还原反应
一、还原
1. 凯惜钠-乌尔夫-黄鸣龙法
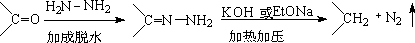
缺点:高温,需要在高压釜或封管进行。操作不便,反应时间长(100h以上)
原因:
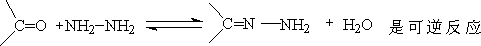
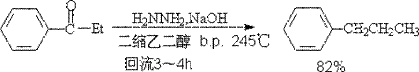
黄鸣龙改进方法:采用高沸点溶剂,蒸出水。
此法适用于对酸不稳而对碱稳定的酮,醛,羰基的还原。
2. Clemmensem(克莱门森)法:

此法适用于对酸稳定的醛酮(对芳香酮较好)的还原。
3. 硫代缩醛脱硫加氢法
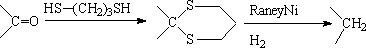
这三种方法可以互相补充。
4. 与活泼金属反应

酮在镁,汞齐等作用下,生成对称的醇:
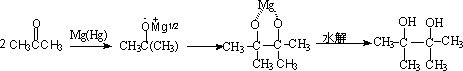
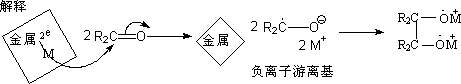
若可制备对称的二醇,需要有利于偶联,而抑制自由基负离子的进一步质子化的反应条件,为此目的,偶联还原在烃类溶剂中进行。镁,铝,锌的汞齐是常用的金属。
二、氧化
1. 与Tollens试剂反应
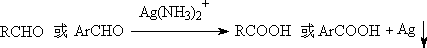
主要用于鉴定醛
Ag(NH3)2+不氧化双键,在合成上,可用于不饱和醛制备不饱和酸:

2. Baeyer -Villiger反应 机理:
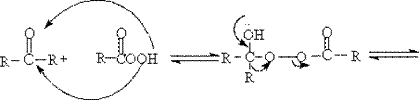

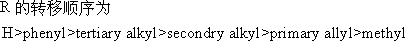
《有机化学导论》(英):400页
例:

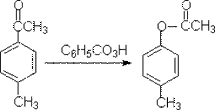
3. 与O2反应
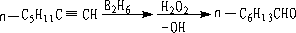
§6.醛酮的制法
1.炔烃的水合和胞二卤代物的水解
① 炔烃水合:
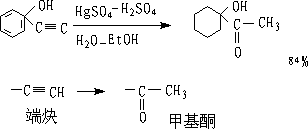
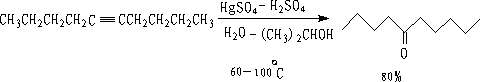
适合于端炔或对称的炔。
用硼氢化一氧化法进行水合,由末端炔可以制得醛。
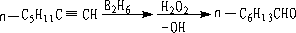
② 胞二卤代物水解:
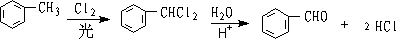
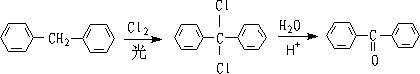
2.由烯烃制备
① 烯烃的氧化
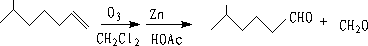
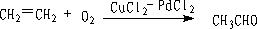
② 氢甲醛化法(Hydroformylation)
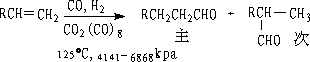
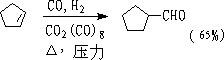
不对称烯烃主要产物直链烃基醛,对称烯烃可得单一产物。
3. 由芳烃侧链α-H的氧化
①
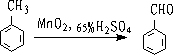
控制氧化条件,氧化剂不要过量。
② CrO3-醋酐作氧化剂
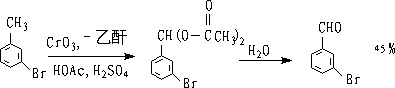
二乙酸酯不易连续被氧化
③
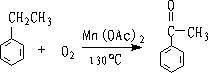
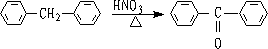
4.由醇氧化或脱氢
① Na2Cr2O7
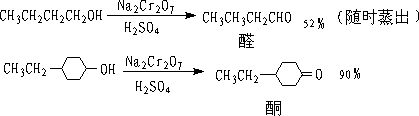
② CuO
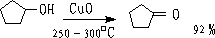
③ CrO3-吡啶(萨瑞特试剂)——CrO3(C5H5N)2
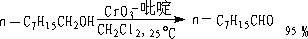
氧化很好地控制在生成醛的阶段,且双键不受影响。
④ [(CH3)2CH-O]3Al (欧芬脑氧化法)

双键不受影响
⑤ CrO3-H2SO4 (琼斯试剂)

不饱和仲醇可得到相应的不饱和酮。
5.傅瑞德尔-克拉夫茨 (Friedel-Crafts)酰基化
是制备芳酮的重要方法,优点是不发生重排,产物单一,产率高。
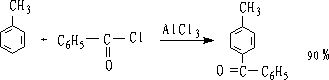
可通过分子内酰基化制备环酮

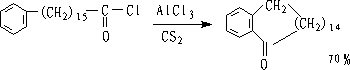
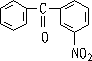
思考题: 如何由芳烃制备?
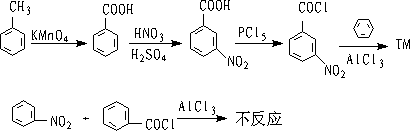
6.盖德曼-柯赫(Gattermann-Koch)反应
在催化剂存在下,芳烃和HCl,CO混合物作用,可以制得芳醛
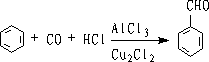
该反应叫盖德曼-柯赫反应,它是一种特殊的傅氏酰基化反应。
如果芳环上有烃基、烷氧基,则醛基按定位规则导入,以对位产物为主。
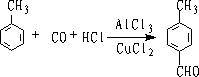
如果芳环上带有羟基,反应效果不好,如果连有吸电子基,则反应不发生。
7.瑞默-梯曼反应 (Reimer-Tiemann)
苯酚在NaOH存在下和CHCL3作用,生成酚醛。
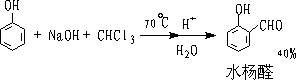
主要生成邻位产物:
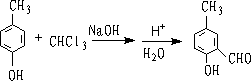
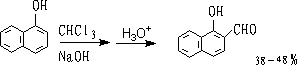
瑞默-梯曼(Reimer-Tiemann)反应按下列机理进行,首先氯仿在碱溶液中形成二氯卡宾:

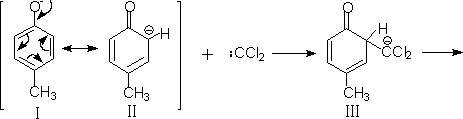
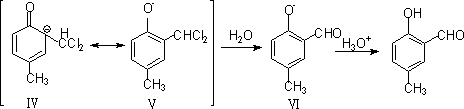
此外,二氯卡宾还可以攻击(ⅰ)的带甲基的碳原子,形成环己二烯酮衍生物:
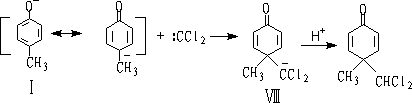
(ⅳ)或(ⅴ)中-CHCl2上的氢过去通常认为是与它相连的苯环碳原子上的氢发生1,2转移过来的,但肯普(D.S.Kemp)等发现并非如此, -CHCl2上的氢是来自溶剂,然后苯环在把一个氢给予溶剂,为了证实这点,肯普在含氚的水(THO)中进行了Reimer-Tiemann反应,生成的水杨醛中,醛基含有99.6%的氚只有不到0.4%的氚在苯环上,这表明醛基的氢是来自溶剂,即:
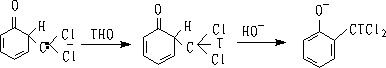
参考书:邢其毅等<<基础有机化学>>(下册) (1983) P: 752-753
8.维路斯梅尔反应(Vilsmeier-Haack反应)
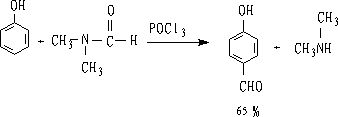
通常是指应用N,N-二取代甲酰胺和POCl3使芳环(主要是酚类和芳胺类)甲酰化反应。
9.酰氯还原制备醛
① 罗森孟德(Rosenmund)还原

用部分毒化的(降低了活性)钯催化剂进行催化氢化,在这种条件下,只能使酰氯还原为醛,而醛不会进一步还原成醇。
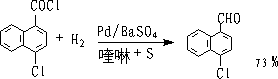
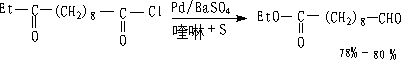
② 三叔丁氧基氢化锂铝还原
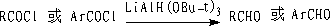
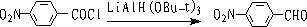
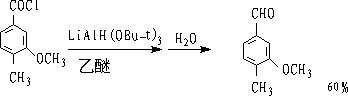
LiAl(OBu-t)3只能还原酰氯,而对醛无作用。
10.酰氯与金属有机试剂作用
① 与二烃基铜锂试剂作用
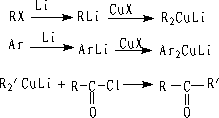
R与R’ 可以是烷基或芳基
二烃基铜锂与酰氯反应成酮。 不与-NO2, -CN, C=O, -COOR反应。
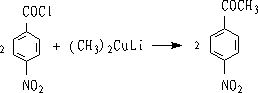
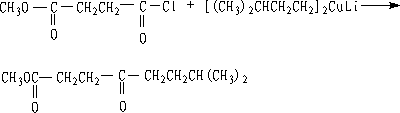
② 与二烃基镉试剂作用
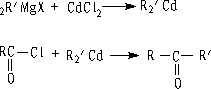
二烃基镉试剂只与酰氯反应,不与酮反应。
§8. 醛酮的来源和用途
(自学)