第十八章 其他含氮化合物
§1硝基化合物
分子中含有硝基(-NO2)的化合物称为硝基化合物。硝基取代芳环上的氢生成的芳香族硝基化合物ArNO2易由硝化反应而得,有重要的工业用途;硝基取代链烃分子中的氢生成的脂肪族硝基化合物RNO2,只有几个简单的化合物有工业用途外,其余用途较少。
1.1 硝基化合物的结构
根据硝基化合物具有较高的偶极矩,键长测定两个氧原子和氮原子之间的距离相等,从价键理论观点看,氮原子的sp2杂化轨道形成三个共平面的σ键,未参加杂化的一对电子的p轨道与每个氧原子的p轨道形成共轭体系,因此,硝基化合物的分子结构可以表示如下:

共振结构式:
氮带一个正电荷,每个氧各带½负电荷,这与硝基化合物高的偶极矩相联系。根据R的不同,偶极矩在3.5D和4.0D之间,由于硝基化合物的偶极特征,结果比相同分子量的酮沸点高(挥发慢)。如硝基甲烷(MW61)沸点101℃,丙酮(MW58)沸点56℃。意外地,在水中溶解度低,在水中硝基甲烷的饱和溶液,以重量计少于10%,而丙酮完全溶于水。
1.2 芳香族硝基化合物的物理性质(自学)
1.3 芳香族硝基化合物的反应
芳香族硝基化合物由于能还原成芳胺,而后者可以转变成多类有几化合物,因而在有机合成上有相当的重要性。并且由于硝基具有吸电子效应,对芳环上的亲核取代反应有活化作用。
⑴ 还原:硝基化合物可以依次还原为亚硝基化合物→N-烃基取代羟胺→氨。

硝基化合物在强酸存在下,用铁、锡等金属还原,产物为伯胺,金属的作用是提供电子。例如:

在中性或弱酸性溶液中N-苯基羟胺还原速率很慢,产物为N-苯基羟胺。例如:

在碱性溶液中,亚硝基苯和N-苯基羟胺继续还原的速率都减慢,因此,产物为氧化偶氮苯或其他还原产物。例如:

⑵ 芳环上的亲核取代反应
芳环上带有吸电子的取代基时,使环上的电子云密度降低,难以发生亲电取代反应,而易进行亲核取代反应。硝基是强吸电子基团,它使苯环上难以进行亲电取代反应,但在硝基的邻位或对位上的卤原子易被亲核试剂取代(离去基团也不限于卤原子)。如:


反应机理:加成-消去机理 (底物先与亲核试剂生成加成产物,然后离去基团在带着一对电子离开。)

(3)脂肪族硝基化合物
脂肪族硝基化合物为无色有香气的液体,在水中的溶解度很小。能溶于多数有机溶剂。例如硝基甲烷就是一种有用的溶剂。
硝基甲烷和其它有α-H的伯和仲硝基化合物在水溶液中与氮酸形成动态平衡:(氮酸的结构与羧酸相似)

① 亨利(Henry)反应:

硝基是吸电子取代基,其α-H有明显的酸性,其共轭碱的结构可用共振式表示:


② 还原:

③ 亚硝酸盐的烃化
与卤代烃:

两者的比例与卤代烃的结构有关,生成硝基烷烃比例为:
伯卤代烃〉仲卤代烃〉叔卤代烃
卤代烃中卤素被取代的难易是:I>Br>Cl>F
§2 重氮和偶氮化合物
1. 重氮甲烷
1.1. 结构:它的分子式是CH2N2,重氮甲烷的结构比较特别,根据物理方法测量,它是 一个线型分子,但是没有一个结构能比较完满的表示它的结构。共振论则用下列极限式来表示:


实验测量结果表明,这类化合物的偶极矩不太高,这可能是因为重氮甲烷的分子内一个碳原子和两个氮原子上的p电子互相重叠而形成三个原子的π键,因此引起了键的平均化。
1.2 重氮甲烷的制备:
重氮甲烷很难用甲胺和亚硝酸直接作用制得,最常用而又非常方便的制备重


1.3 重氮甲烷的性质和反应
重氮甲烷是一个有毒的气体,具有爆炸性,所以在制备及使用时,要特别注意安全。它能溶于乙醚,并且比较稳定,一般均使用它的乙醚溶液。重氮甲烷非常活泼,能够发生多种类型的反应,在有机合成上是一个重要的最理想的甲基化剂,能溶于有机溶剂,反应速度快不需要催化剂,分解成N2,无分离问题,产率很高,其反应如下:
1.亲核反应:
⑴与酸性化合物的反应:




⑵与酰氯作用:










Wolff(沃尔夫)重氮酮重排为烯酮:

阿恩特—艾斯特(Arndt-Eistert)反应:

这个反应称Arndt-Eistert反应,其中包括重氮酮的wolff重排,该反应是将羧酸变成它的高一级同系物(即碳链增长)的重要方法之一。

⑶与醛酮反应
重氮甲烷与醛酮反应能得到比原醛酮多一个碳原子的酮。




(4) 1,3—偶极环加成反应
重氮化合物的1,3—偶极体和单个的C=C键很难发生反应,只有共轭体系中的C=C键(如苯乙烯)或α-碳原子上有拉电子基团的双键(如α,β—不饱和的羰基化合物),他们和重氮化合物加成生成二氢吡唑衍生物。


(5)形成卡宾(Carbene :CH2)

卡宾是一个反应中间产物,呈中性,只能在反应中短暂的存在(约能存在一秒钟),它的结构是一个碳与两个氢连接组成。碳上有二个孤电子,如果这两个孤电子成对(自旋相反  )称单线态卡宾(singlet Carbene),如果两个孤电子不成对(自旋平行)称三线态卡宾(triplet Carbene)
)称单线态卡宾(singlet Carbene),如果两个孤电子不成对(自旋平行)称三线态卡宾(triplet Carbene)

实际上,这样考虑单线态卡宾和三线态卡宾的结构是过于简单化了,最近理论计算和实验测定的结果表明:单线态卡宾的键角约103°,三线态卡宾的键角为136°
卡宾的一个重要反应是可以与双键加成得环丙烷化合物,下面是一般反应方程式:

① Simmons-Smith反应
而碘甲烷在锌-铜偶(在锌粉和3%盐酸的混合物中,加入2%硫酸铜溶液,在锌粉表面沉积少量的铜,从而使锌粉活化)存在效能与烯烃中的双键加成,生成环丙烷类化合物。例如:

Simmons-Smith反应是有立体特异性的顺式加成反应,烯烃的构型保持不变:

(6) 染料简介(偶氮染料)
染料是一种可以较牢固的附在纤维上耐光和耐洗性的有色物质。根据化学结构一般分为偶氮染料、靛系染料、蒽醌染料、芳甲烷染料、醌亚胺染料、喹啉染料、酞菁染料和黄酮染料等。
㈠ 有机化合物的分子结构与颜色的关系:
1.有机化合物分子中共轭体系的增长导致颜色的加深。这是因为共轭体系越长,分子轨道跃迁能量级差越小,越容易激发。因此,激发光波长移向长波方向。

我们视觉感到的颜色和吸收的是相补的。就是吸收白光中某一种光,剩下感觉到的颜色。假若一个分子主要是吸收黄光,放出来的光就是蓝色的。如:黄色与蓝色为互补色。
表:物质颜色和吸收光颜色的关系:
|
物质颜色 |
吸收光颜色和波长( nm ) |
|
黄绿 |
紫 400-450 |
|
黄 |
蓝 450-480 |
|
橙 |
绿蓝 480-490 |
|
红 |
蓝绿 490-500 |
|
紫红 |
绿 500-560 |
|
紫 |
黄绿 560-580 |
|
蓝 |
黄 580-600 |
|
绿蓝 |
橙 600-650 |
|
蓝绿 |
红 650-750 |
2.在有机化合物共轭体系中引入助色基或生色基一般伴随着颜色的加深。
光谱术语:
① 发色基团(生色团)(Chromophore):共价键不饱和原子基团能引起电子光谱特征吸收的,一般为带有π电子的基团。
如:  等。
等。
② 助色基团(Auxochrome):饱和原子基团本身在200nm前没有吸收,但当它与生色基相连时,它能增长最大吸收峰的波长并增大其强度。一般为带有p电子的原子或原子团。如:  等。
等。
助色基被引入共轭体系时,这些基团上未共用电子对参与共轭体系,提高了整个分子中π电子的流动性(使HOMO能级上升,能量增加)从而降低了分子的激发能,使化合物吸收向长波方向移动,导致颜色加深。

生色基引入共轭体系时,同样能参与共轭作用,使共轭体系中π电子流动性增加,使分子激发能降低,吸收波向长波方向移动,颜色也加深。

若共轭体系两端的两个基团的电子效应协调时,增加共轭体系的稳定性,从而把吸收的光波移向长波方向。

若共轭体系两端的两个基团的电子效应不协调时,对于向长波移动没有多大帮助。

3.有机化合物的离子化对颜色产生影响
当有机化合物的分子离子化时,如果供电子取代基的给电子趋势,吸电子取代基的吸电子能力加强时,则最大吸收向长波方向移动,颜色加深。若由于离子化的结果给电子基的供电子能力降低,则结果相反。



(二)助色基团在染料中的作用
1. 使染料的颜色加深。
2. 使染料较牢固地固定在纤维上。(有一些研究者认为染色是一种物理的吸附现象或由于氢键的结合。)
3. 使染料具有水溶性,便于染色。(  )
)
(三)染料的染色过程及反应原理
染料种类繁多,偶氮染料是其中之一,在所有已知染料中,偶氮化合物约占半数以上。在纺织工业应用上,他们包括了碱性、酸性、直接媒染和冰染染料等几大类。下面以冰染染料中凡拉明蓝为例说明冰染染料的染色过程及反应原理。
凡拉明蓝本身不溶于水,所以可按冰染染料法来染色,染色时,先将织物用酚类的钠盐浸润(合成凡拉明蓝所用的酚是钠夫妥AS),然后再让浸有酚的织物通过色基,即芳伯胺得重氮化合物溶液合成凡拉明蓝。其反应如下:

§3 分子重排
分子重排是指在试剂、加热或其他因素的影响下,分子中某些原子或基团发生转移或分子碳胳改变生成新的物质的反应。
下面就离子型亲核和亲电重排和游离基重排进行简要的讨论。
一.亲核重排
亲核重排最多的是1,2—位移,即在反应中,一个原子或基团带着一对电子转移到相邻的缺电子的原子上。

1. 重排到缺电子的碳原子上

(1)1— 丙基阳离子的重排:


(2)片呐醇重排



其他的取代乙二醇(统称片呐醇类)在强酸作用下都会发生片呐醇重排,结构可用下列通式表示:

其中R可以相同也可以不相同,可以是烷基也可以是芳基。若R不相同时,怎样决定片呐醇重排方向和预测重排的产物?这就可考虑:
① 在两个羟基中,哪一个羟基首先被质子化形成盐,生成碳正离子?能生成稳定碳正离子的碳上的羟基优先被质子化。

② 生成碳正离子后,相邻的两个基团中哪一个优先发生转移。
基团转移顺序通常是:芳基>烷基。
亲核强的,电子密度高的先转移。转移基团的电子密度越高,亲核能越大,越易转移。

当生成碳正离子之后,相邻的两个芳基中哪一个转移,一般地说,若空间位阻不大时,主要决定于这两个芳基亲核的趋势,亲核趋势大的芳基发生转移。芳香环的电子密度越高,则转移的倾向越大。


能与碳正离子形成环丙烷稳定中间体的基团优先转移。邻甲氧苯基转移倾向较低,这可能是空间位阻的原因。
③ Wagner—Meerwein重排:
当ß—取代醇如:

被脱水或用试剂(如:HX,PCl5,SOCl2)处理或卤化氢加成到多环烯以及多环卤化物消除卤化氢时,都时常发生分子中碳骼的重排。这类反应在1899年被Wagner发现。后来Meerwein加以发展,因而称为Wagner—Meerwein重排。
Wagner—Meerwein重排也是通过碳正离子中间体的生成而进行的。
例1:


多环烯烃类在酸的存在下也发生Wagner—Meerwein重排,例如a—蒎烯
例2.


虽然时第三碳正离子重排为第二碳正离子,但是由含四元环的碳正离子扩张到五元环的碳正离子之后,张力减小了。
例3.

例4.

它是否经历了一个碳离子中间体?我们先看一个实验事实:

若按照重氮盐分解生成碳正离子,那么产物应为C6H5CH2C*H2OH。因此,认为反应是经过下列所示的中间体。

所以,反应不是经过碳正离子中间产物,而是中间产物:

R为乙烯基同样经过环丙烷中间体:

这是苯基或乙烯基当作邻位参与基团,他们的π-电子能稳定相邻的碳正离子的缘故。
例5.

反应历程:


(4)重排反应中的立体化学
在重排反应中,如果迁移基团本身是一个手性基,那么迁移后其构型是否发生变化?迁移起点的碳原子和迁移到达的终点碳原子,它们的构型是否发生变化?迁移基团和离去基团在空间位置上有什么关系?这些都是属于重排反应的立体化学,弄清这些问题,对于预测重
排产物极其构型是很重要的。
① 实验证明,在重排反应1,2—迁移中,迁移基团的构型没有改变。这可以从过渡态的分子轨道模型来理解:

开始时,迁移基团—CR1R2R3与C2以sp3—sp3杂化轨道相互重叠形成σ-键,在过渡态中—CR1R2R3与C2成键的两个电子为三个原子共用,—CR1R2R3基团的sp3轨道和C1,C2的p轨道,结果形成了一个三中心二电子的过渡态。然后—CR1R2R3与C2断裂,形成( II )。
② 实验证明迁移的起始点和终点的碳原子都有构型上的反转



③ 重排的立体化学研究说明,在重排过程中转移的基团和离开的基团彼此处于反式。


重排反应在有机合成中的应用:
例1

历程:


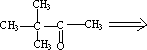
例2.从廉价的原料合成3,3—二甲基—2-丁胺



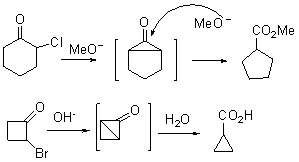
例3.从环己酮合成环庚酮。

合成:

2.重排到缺电子的氮原子
(1)Beckmann重排

醛或酮肟在酸的作用下重排为酰胺,这反应称为Beckmann重排,其反应历程表示如下:


Beckmann重排是经由生成了一个氮正离子中间体,与氮正离子相邻的烃基(与羟基处于反式)转移到氮原子上,接着形成碳正离子,水分子加到碳正离子上生成吸电子很强的—OH2基,然后消去质子重排成酰胺。
如:二环[4,3,0]壬酮—7—肟的E和Z异构体重排得不同的产物。


与羟基处于反式的烃基转移到氮原子上。
环己酮肟Beckmann重排后变成己内酰胺。

这是合成聚己内酰胺的单体。
Beckmann重排给我们提供了由醛、酮经圬制取酰胺的方法。
作业:

(2) Hofmann重排
溴和碱的水溶液与酰胺作用时,放出二氧化碳,生成少一个碳原子的胺:

这是制备伯胺的一种重要方法,叫做Hofmann降解。反应历程表示如下:


这里,第一步形成的N—卤代酰胺曾经被离析得到,在第二步中卤代酰胺被碱提取掉一个质子(卤代酰胺的氮原子上连接着两个吸电子基团,因而是酸性的)。第三步包括两个过程:脱掉溴形成乃春(氮烯)和R基团转移,大部分资料都表明这两个过程是协同的。
还有一种观点认为:


若含手性碳原子的α—苯基丙酰胺进行Hofmann重排反应,发现在重排反应中旋光性
(95.5 %光学纯度)保留下来(构型保持不变):

这说明迁移基团没有脱离分子,因而迁移基团的构型保持不变。
作业:

3.Wolff重排(碳烯的重排)
α—重氮酮在Ag2O存在下光照或加热失去N2,重排得到反应性极高的烯酮,这反应称为Wolff重排反应。

4.重排到缺电子的氧原子:
(1)过氧化氢烃的重排



(2) Baeyer—Villiger重排

在过氧化苯甲酸作用下,酮转变为相应的酯。


基团转移的一般顺序为:H>C6H5- >叔烷基>仲烷基>伯烷基 >甲基。
因而,甲基酮总是生成乙酸酯,这是较大基团迁移的结果。按照转移总是向着电子缺乏中心这一普遍原则,迁移基团的构型在拜尔—维立格氧化反应中保持不变。(王积涛译《高等有机化学》P298~299)


二、亲电重排
前面所讨论的亲核重排是指分子中消去一个负离子,留下一个碳正离子或其它缺电子的中
心,接着与之相邻的基团带着一对电子转移过来。相反,亲电重排反应是在分子中消去一个
正离子,留下一个碳负离子或具有活泼的未共用电子对的中心,而与之相邻的基团以正离子
的形式转移过来,该转移基团所遗留的一对电子,可以吸取一个质子.

亲电重排反应较少,这里仅举Stevens重排为例说明如下,含有活泼的α-氢原子的季铵盐
或锍盐,在强碱作用下α-氢原子以质子形式脱落形成碳负离子,烃基从氮原子或硫原子
转移到相邻的负碳离子上,这一反应由Stevens等人发现,所以称为Stevens重排.


作用物中氮原子或硫原子的正电荷和羰基使亚甲基活化,容易生成负碳离子。迁移基团常为
苄基或烯丙基.
实验证明在反应过程中迁移基团的构型不变.

说明C-N键的破裂和C-C键的生成是协同进行的.
三.游离基重排
游离基重排是指生成游离基后, 游离基发生重排的反应. 游离基重排研究的最多的是
1,2-芳基转移,即一个芳基从一个位置转移到相邻的位置上去.
例如,β-苯基异戊醛,在氯苯中有二叔丁基过氧化物(di-t-butyl peroxide)存在下
形成大约等量的正常产品ph-CMe3和发生由苯基转移形成的重排产品.






值得注意的是游离基重排的限度比碳正离子小的多。在上述实例中只有50%转移。再就
是这里没有甲基转移,一般在常温情况下不发生甲基的游离基转移.除芳基以外,乙烯基
和乙酰氧基、卤素也能转移。
四.芳香族重排

在酸的作用下,与X取代基相连的原子或原子团,转移到芳环的邻位或对位。
X是氮或氧,若Y是强的吸电子基团,则重排反应最容易发生。这种重排反应涉及到芳环,所以称为芳香重排。
1.N-磺基苯胺的重排:


2.联苯胺重排
氢化偶氮苯与强酸作用,发生重排反应生成联苯胺

联苯胺重排可能是通过正离子自由基进行的:




3.Claisen重排
Claisen于1912年发现,苯基烯丙基醚加热至200℃时,烯丙基从氧原子转移到苯环的邻位
.若两个邻位已有了取代基,则转移到对位,生成烯丙基酚:



4. 弗赖斯(Fries)重排

一般在低温下生成对位异构体,在较高温度下生成邻位异构体。
Fries 重排的历程还十分清楚,对位异构体可能是由分子内的酰化反应生成的。邻位异构体可能是分子重排产物。

参考书:《有机化学》下册 南京大学编 P166—188
《物理有机》下册 高振衡编 P315--334
5.二苯基羟乙酸重排(Benzilic acid rearrangement)

① 二苯基羟乙酸


6.Favorskii rearrangement