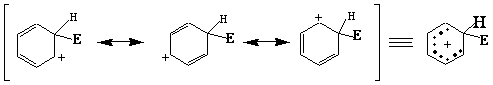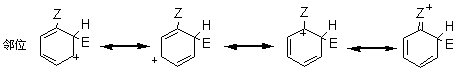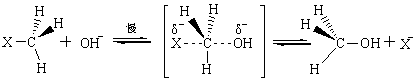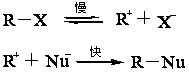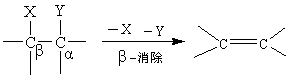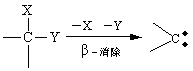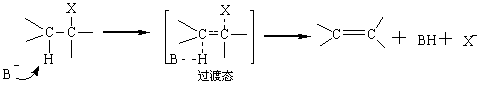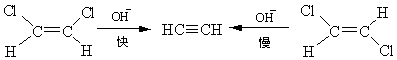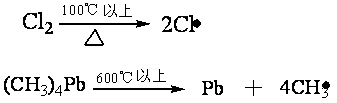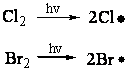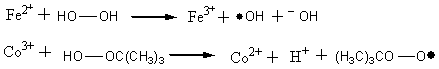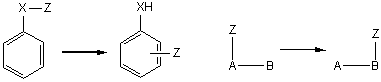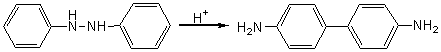|
精细有机化学品的合成与工艺学 第二章 精细有机合成的理论基础
作者:佚名 转贴自:本站原创 点击数:143
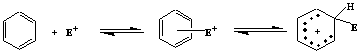
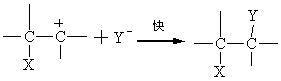
第二章 精细有机合成的理论基础 精细有机合成反应按照进行方式不同,从形式上可以分为取代反应、加成反应、消除反应,以及其他重排反应等。每一种反应又可以分为若干种类。 取代反应根据反应试剂性质和反应物分子中碳-氢键断裂方式不同,分为亲电取代、亲核取代和游离基取代反应。加成反应根据加成的基本途径不同,可以分为亲电加成、亲核加成、游离基加成和环加成。消除反应可以根据被消除原子或原子团位置不同,分为β-消除和α-消除等。重排反应也可以分为许多类。 2.1 反应试剂的分类 2.1.1 极性试剂 极性试剂是指那些能够供给或接受一对电子以形成共价键的试剂。极性试剂又分为亲电试剂和亲核试剂。 2.1.1.1 亲电试剂 亲电试剂是从基质上取走一对电子形成共价键的试剂。这种试剂电子云密度较低,应中进攻其他分子的高电子云密度中心,具有亲电性能,包括以下几类: 阳离子:NO2+、NO+、R+、R-C+=O、A rN2+、R4N+等; 含有可极化和已经极化共价键的分子:Cl2、Br2、HF、HCl、SO3、RCOCl、CO2等; 含有可接受共用电子对的分子(未饱和价电子层原子的分子): AlCl3、FeCl3、BF3等; 羰基的双键。 氧化剂:Fe3+、O3、H2O2等。 酸类。 卤代烷中的烷基:R-X。 由该类试剂进攻引起的离子反应叫亲电反应。例如:亲电取代、亲电加成。 2.1.1.2 亲核试剂 把一对电子提供给基质以形成共价键的试剂称亲电试剂。这种试剂具有较高的电子云密度,与其它分子作用时,将进攻该分子的低电子云密度中心,具有亲核性能,包括以下几类: 阴离子;0H-、RO-、ArO-、NaSO-、NaS-、CN-等。 极性分子中偶极的负端:NH3、RNH2、RR`NH、ArNH和NH2OH等; 烯烃双键和芳环;CH2=CH2,C6H6等 还原剂:Fe2+、金属等。 碱类。 有机金属化合物中的烷基:RMgX、RC=CM等 由该类试剂进攻引起的离子反应叫亲核反应。例如,亲核取代、亲核置换、亲核加成等。 2.1.2 游离基试剂 含有未成对单电子的游离基或是在一定条件下可产生游离基的化合物称游离基试剂。例如,氯分子(C12)可产生氯游离基(C1·)。 2.2 亲电取代反应 精细有机合成中的亲电取代反应也可称为阳离子型取代反应。芳香环是一个环状共轭体系,由于环上π-电子云密度较高,容易发生亲电取代反应。 2.2.1 芳香族π-络合物与σ-络合物 芳烃具有和一系列亲电试剂形成络合物的特性。同亲电能力较弱的试剂形成络合物,它与芳环平面两侧的环状π-电子云发生松散结合,亲电质点同芳环的碳原子之间没有形成真正的化学键。 而亲电能力较强的试剂同芳烃则在反应瞬间能从芳环上夺取一对电子,与环上某一特定的碳原子形成σ-键,形成σ-络合物(或称芳阳离子)。σ-络合物和π-络合物之间存在着平衡,σ-络合物较为稳定,在某种情况下,能将其分离得到。例如,苯三氟甲烷、硝基氟和三氟化硼在零下100℃时生成一个黄色的结晶态络合物,即σ-络合物。它在零下50℃以下是稳定的,高于零下50℃则分解成间硝基三氟甲苯、氟化氢和三氟化硼。
已经有多方面的研究结果足以证明,大多数亲电取代反应是按照经过σ-络合物中间体的两步历程进行的。而亲电质点E+的进攻和质子的脱落同时发生的一步历程,则一直没有发现过。至于在亲点质点进攻芳环以前,质子就已经脱落下来的单分子历程,只在极个别的情况下才遇列。
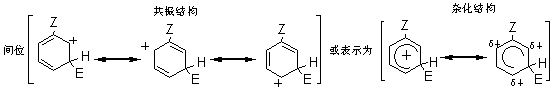
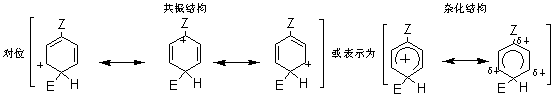
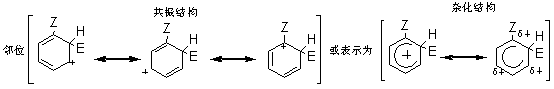
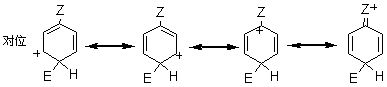
2.2.2.1 动力学同位素效应 对于任何反应,所谓“动力学同位素效应”是指如果将反应物分子中的某一原子用它的同位素代替时,该反应速度所发生的变化,例如,氢的三种同位素氢H、氘D和氚T的质量数不同,三种氢构成的碳氢键断裂速度是有差别的,即质量大的断裂较慢。据据实验数据,C-H键的断裂速度约比C-D键快7倍;约比C-T键快20倍。若(1)按照两步历程而且速度控制步骤是H+的脱落(即k2<k1),(2)按照一步历程或者(3)按照单分子历程,那么它的同位素效应kH/kD都将接近于7,或者kH/kT都将接近于20。若按照两步历程而且速度控制步骤是σ-络合物的生成,将没有同位素效应。 2.2.2.2 σ-络合物的分离和其相对稳定性 反应σ-络合物生成是控制步骤时,它一经生成就快速地脱质子而转变为产物。一般不能把它们分离出来,也不易观察到它们的存在。仅在某些特殊情况下,才能分离出中间产物σ-络合物。例如,苯三氟甲烷、硝基氟和三氮化硼在零下100℃时生成的黄色结晶态络合物,它是该硝化的中间产物σ-络合物,然后再分解形成产物间硝基三氟甲苯。 芳香亲电取代反应最初步骤是亲电试剂进攻芳香环,首先形成π-络合物,然后转变为σ-络合物。芳烃溶于无水液态氟化氢时存在着π-络合物和σ-络合物的平衡。 2.2.3 芳香族亲电取代定位规律 2.2.3.1 影响定位的主要因素 芳环上已有一个或几个取代基,若再引入新取代基时,其进入的位置和反应进行的速度,主要取决于以下因素。 (1)已有取代基的性质,包括极性效应和空间效应。如果已有几个取代基则决定于它们的性质和相对位置。 (2)亲电试剂的性质,也包括极性效应和空间效应。 (3)反应条件主要是温度、催化剂和溶剂的影响。 在上述因素中,最重要的是已有取代基的极性效应。在芳香系取代反应中,苯系的亲电取代研究得最多,也最重要。 2.2.3.2 两类定位基 在亲电取代中,苯环上已有取代基对新取代基的定位作用有两种类型,即邻、对位定位和间位定位。通常把邻、对位定位基叫做第一类定位基,把间位定位基叫做第二类定位基。 属于第一类定位基的主要有: —O-、—N(CH3)2、—NH2、—OH、—OCH3、—NHCOCH3、—OCOCH3、—F、—C1、—Br、—I、—CH3、—CH2Cl2、—CH2COOH、—CH2F等。 属于第二类定位基的主要有: —N(CH3)2、—CF3、—NO2、—CN、—SO3H、—COOH、—CHO、—COOCH3、—COCH3、—CONH2、—N+H3、—CCl3等; 这里所谓邻、对位定位或间位定位,都是对反应的主要产物而言。 2.2.5.3 苯环的定位规律 1.已有取代基的极性效应在不可逆亲电取代中,可以根据苯环上已有取代基的极性效应,对生成个异构体的σ-络合物的稳定性来解释定位作用。苯一取代物发生亲电取代可以生成邻、对和间位的三种σ-络合物。每一种络合物都可以看作是三种共振结构杂化的结果。在邻位和对位的络合物中,都有一个共振结构,其正电荷集中在同已有取代基Z相连的碳原于上。因此在杂化结构中,同Z相连的碳原子上具有部分正电荷。在间位的络合物中,三个共振结构在同Z相连的碳原子上都没有正电荷集中。因此在它的杂化结构中,同Z相连的碳原子上没有部分正电荷。这种差别是解释已有取代基定位作用的基础。
当Z和苯环之间有共轭效应时,某些情况下同诱导效应的方向一致,而另一些情况,则同诱导效应的方向相反。一般来说,共轭效应起主导作用。当Z中同苯环相连的原子具有未共有电子对时,可以把未共有电子对分散到苯环上,使络合物稳定,尤其是对于邻位和对位络合物,还可以多画出一个正电荷集中在Z上的共振结构。 这个额外的共振结构比其他共振结构更稳定,即在杂化结构中邻位和对位络合物更稳定。因此这类取代基使苯环活化,而且是邻、对位定位。
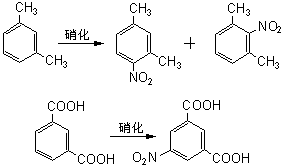
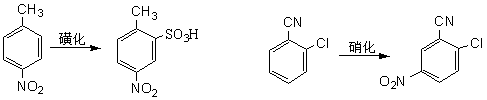
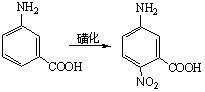
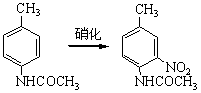
根据以上讨论,各种取代基可归纳为以下三类: (1)取代基只有正的诱导效应,例如烷基,它们都使苯环活化,而且是邻、对位定位。其中甲基还具有超共轭效应,其活化作用大于其他烷基。 (2)取代基中同苯环相连的原子具有未共有电子对,例如:—O–、—NR2、—NHR、—NH2、—OH、—OR、—NHCOR、—OCOR、—F、—C1、—Br、—I等,其未共有电子对和苯环形成正的共轭效应(+I),它们都是邻、对位定位基。除了正共轭效应外,这些取代基也都具有诱导效应,其中—O–为正诱导(+I),其他的都具有负的诱导效应。对于氨基和羟基,其正的共轭效应(+I)大于负的诱导效应(-I),所以它们都使苯环活化。对于卤素,其正的共轭效应小于负的诱导效应,所以使苯环稍稍钝化。 (3)取代基具有负的诱导效应,而且同苯环相连的原子没有未共有电子对,例如:—N+R3、—NO2、—CF3、—CN、—SO3H、—CHO、—COR、—COOR、—CONH2、—CCl3、和—NH3等,其中某些除诱导效应外,还有负的共轭效应,它们都使苯环钝化,而且是间位定位。 2.已有取代基的空间效应 苯环上已有取代基的空间效应这里指的是空间障碍作用。但烷基苯一硝化时随着烷基体积增大,邻位异构产物的比例减小。 3. 亲电试剂的极性效应 亲电质点E+的活泼性对定位作用也有重要影响。当E+极活泼时,kT/kB值小,即E+进攻甲苯或进攻苯的选择性很差,同理进攻甲苯环上不同位置的选择性也很差,结果生成相当数量的间位异构产物。例如甲苯的C-烷化就接近这种情况,说明—CH3、—CH2CH3等烷基阳离子部是非常活泼的亲电质点。 反之,当E+极不活泼时,它进攻甲苯和苯的选择性很好,kT/kB主要决定于甲苯和苯的相对活性,即主要决定于甲基的活化作用,因此kT/kB很大。同理,E+进攻甲苯各不同位置的选择性也很好,几乎不生成间位异构产物。例如甲苯的卤化和C-酰化就接近这种情况,说明分子态氯(Cl2)和—COCH3是很弱的亲电质点。 4.新取代基的空间效应 新取代基的空间障碍也会影响邻位异构产物的生成比例。 5.反应条件的影响 (1)温度的影响 温度升高可以使不可逆的磺化和C-烷化转变为可逆反应。温度的变化对不可逆亲电取代的异构产物比例也有影响。例如硝基苯的再硝化反应,升高硝化温度,主产物间二硝基苯的生成比例将下降。 (2)催化剂的影响 催化剂可以改变亲电试剂的极性效应或空间效应。例如甲苯用混酸硝化时,加入一定量磷酸,可以提高对位异构体的收率,即对位产物组成由36%提高到40%。这可能是磷酸与-NO2构成的络合物作为进攻质点,体积增大,使邻位异构产物减少,对位体增加。催化剂也可以改变反应历程,如蒽醌的磺化有Hg盐时,磺基进入α位,无Hg盐进入β位。 (3)介质的影响 主要是介质酸度的影响,例如,乙酰苯胺的硝化,用乙酸酐比用硫酸作介质能得到更多的邻位异构产物。 6. 已有两个取代基的定位规律 当苯环上已有两个取代基,引入第三个取代基时,新取代基进入环上位置主要决定于已有取代基的类型、定位能力的强弱和它们的相对位置。一般有两个取代基定位作用一致和不一致两种情况。
当两个取代基用于同一类型(都用于第一类或第二类定位基),并处于间位,其定位作用是一致的,例如: 可见新取代基很少进入两个处于间位的取代基之间。显然这是空间效应的结果,随着已有取代基或进攻质点体积的增大而更加明显。 当两个取代基属于不同类型,并处于邻位或对位时,其定位作用也是一致的。例如:
如果两个已存取代基对新取代基的定位作用不一致,新取代基进入的位置将决定于已有取代基的相对定位能力。通常第一类取代基的定位能力比第二类强得多。
当两个取代基属于不同类型并处于间位,其定位作用就是不一致的,这时新取代基主要进入第一类取代基的邻位或对位。例如: 当两个取代基属于同一类型并处于邻位或对位,则新取代基进入的位置决定于定位能力较强的取代基。例如:
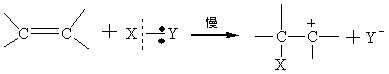
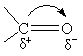
2.3亲核取代反应 精细有机合成中的亲核取代也可称为阴离子型取代反应,进攻试剂的性质和反应物分子中C-H键的断裂方式,可按如下反应通式表示:
反应既包括芳香族亲核取代也包括脂肪族的亲核取代,但应用较多的为脂肪族的亲核取代反应,芳香族的则主要应用于亲核置换反应。 2.3.1 脂肪族亲核取代反应历程 在饱和碳原子上的亲核取代反应,最典型的反应是卤代烷与多种亲核试剂发生的亲核取代常以SN表示,其反应历程有SNl和SN2两种形式。现分别叙述如下: 2.3.1.1 双分子历程(SN2) SN2表示双分子亲核取代。这个历程中旧的化学键断裂和新的化学键形成是同时的,有中间产物生成,反应同步进行。以伯卤代烷反应为例:
亲核试剂的进攻从背面与离去基成180°的位置接近作用物,先与碳原子形成较弱的键,同时离去基与碳原子的连接减弱,两者与碳原子成一条直线,而碳原子其他三个键则处于同一平面内。表明过渡态形成。这一过程进行较慢,是反应的控制步骤。当反应由过渡态转化成产物时。碳原子上另外三个键由平面向另一边翻转,所得产物的构型与原作用物的相反。因为在控制反应速度一步是两种作用物分子参加,所以叫双分子亲核取代。在反应中发生了分子的构型逆转,过去把它称为“瓦尔登转化”。在反应中,凡发生构型逆转的作为SN2型反应的重要标志。 2.3.1.2 单分子历程(SN1) SN1表示单分子亲核取代。在这个反应历程中分两步进行取代反应。第一步是离去基与中心碳原子之间的键发生异裂,生成一个不稳定的碳正离子,是一个慢步骤,第二步是这个高能量的碳正离子中间体,迅速与亲核试剂结合构成新键。
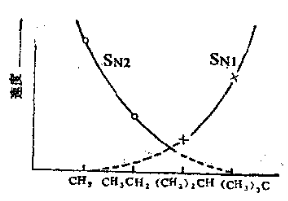
整个反应速度决定于第一步的慢过程。由于该步骤中只有一个作用物分子参加,所以叫做单分子亲核取代。这里,烷基正离子稳定性越大,作用物(R-X)按单分子历程进行反应的倾向越大。该反应历程所以是单分子的,一是由于烷基在α-碳原子上积累,无论从电子效应还是空间效应,都给亲核试剂的进攻造成一定困难,使按SN2历程的反应速度降低;二是由于α-碳原子上电子云密度增大,卤原子就较容易成为负离子而离去,生成的烷基正离子由于超共轭效应存在,有较大的稳定性,这些因素都促使叔卤烷的水解反应按SN1历程进行。 2.3.2 反应的影响因素 影响亲核取代反应历程和速度的因素,主要是作用物的结构、亲核试剂、离去基团和溶剂的性质等,并且它们之间是相互联系的。 2.3.2.1 作用物结构的影响 作用物结构对SN1和SN2反应进度的影响有电子效应和空间效应两种因素。例如卤化烷的水解反应,如果按SN2历程进行,则: 伯卤烷>仲卤烷>叔卤烷 其相对反应速率从伯烷基作用物到叔烷基作用物大约减小103倍。而按单分子历程进化,则: 叔卤烷>仲卤烷>伯卤烷 其相对反应速度大约相差106倍。甲基和伯烷基作用物是按SN1历程进行反应,叔烷基作用物按SN1历程进行反应;仲烷基作用物则介于SN1和SN2的边界状态。可以用下图表示。
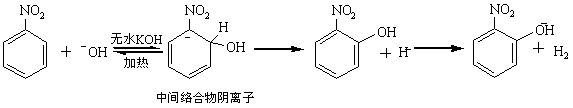
卤代烷烷基对水解速度的影响 在作用物分子中,被进攻的碳原子上有其他给电性基团。如α-氯醚、3-氯丙烯等。由于取代基的p-p共轭或p-π共轭效应,使生成的碳正离子稳定,它们的反应速度比没有取代基的大上千倍、甚至上万倍,其反应按SN1历程进行。 在被进攻的碳原子上有吸电性取代基,如α-卤代羰基化合物、α-卤代氰基化合物等。由于取代基的吸电子作用,使被进攻的碳原子的部分正电荷增加,有利于SN2反应。同时,在形成过渡态时,取代基的π-电子云也可与正在形成键和正在断裂键的电子云交盖,使过渡状态能量降低,使SN2的反应速度增加。 总之在作用物分子中,被进攻的碳原子上有给电性取代基,有利于SNl反应,分子中有吸电性取代基,则有利于SN2反应。 2.3.2.2 被取代离去基团的影响 不论在SN1或SN2的反应中,被取代的基团X均是带着原来共有的一对电子离去,所以X接受电子能力越强越易离去,也越有利于亲核取代反应的进行。一般说来,其被取代的难易次序为: RSO3—> I—> Br—> Cl—> RCOO—> HO—> H2N— 2.3.2.3 亲核试剂的影响 在SN1反应中,亲核试剂的性质对反应速度没有影响,因为亲核试剂不参与整个反应过程的速度控制步骤。在SN2的反应中,亲核试剂参与了过渡态的形成,所以亲核能力的变化对取代反应速度有明显影响。绝大多数试剂的亲核能力与其碱性的强弱是一致的。例如:下列亲核试剂活泼次序为: C2H5Oˉ> OHˉ> PhOˉ> CH3CH2ˉ>H2O 在同族元素的试剂中,亲核性是按电负性的下降而提高。例如: Iˉ>Brˉ>Clˉ>Fˉ和 PhSˉ>PhOˉ 由于原于序数越大,越容易极化,所以给电子倾向也越大。 2.3.2.4 溶剂的影响 溶剂的极性对亲核取代反应机理和反应速度都有很大影响。绝大部分SNl的反应,反应的第一步是一个中性化合物离解为两个带有电荷的离子,因此极性溶剂有利反应进行。并且溶剂极性越大,越使反应速度加快。SN2的反应,由于溶剂与亲核试剂可以形成氢键使亲核试剂活泼性减弱,在反应中试剂与反应物形成过渡态,首先得消耗一部分能量破坏生成的氢键。所以反应在不形成氢键的溶剂中进行有利,反应速度快。总之SNl反应在质子性溶剂中进行有利;而SN2反应在非质子性溶剂中进行有利。 脂肪族亲核取代反应在精细有机合成中较为常用,广泛用于碳杂新键和碳-碳新键的形成。例如用于醇、醚和酯类的合成,即卤代烃发生溶剂解,形成碳-氧新键,例如用水为溶剂生成醇,用醇为溶剂生成醚,用羧酸为溶剂则生成酯。又如用于硫醇、硫醚的合成形成碳-硫新键。用于卤代烃的氨解形成碳-氮新键,这是合成烷胺类重要方法。亲核取代反应中以形成碳-碳新键最为重要,反应是以碳负离子作为亲核试剂,对碳负离子来说,使分子中引入烃基,又称烃基化反应,用以合成腈类和炔烃;如果碳负离子为烯醇负离子,进行烃基化反应是合成酮、羧酸、羧酸酯和腈等化合物的重要合成方法。 2.3.3 芳香族环上氢的亲核取代反应 在该类反应中,亲核试剂优先进攻芳环上电子云密度最低的位置,所以在反应的难易定位规律方面都与芳香族亲电取代反应相反。 以硝基苯的羟基化为例,这类亲核取代反应历程简单表示如下:
2.4 消除反应 消除反应是指有机物分子中同时除去两个原子(或基团),形成一个新分子,通常是不饱和程度增加的反应。由于被除去的两个原子(或基团)的位置不同,消除反应主要分两种,即β-消除和α-消除。 β-消除是生成烯(或炔)烃化合物的反应,即在相邻的两个碳原子上除去两个基团。
β-消除不仅形成碳-碳双键,也可形成碳-氧双键、碳-硫双键和碳-氮双键等。 α-消除是生成卡宾(Carbene)的反应即在同一个碳原子上除去两个基团,也称1,1-消除。
2.4.1 β-消除反应 通过研究消除反应的历程,可分双分子历程(E2)和单分子历程(E1)。 2.4.1.1 双分子消除反应历程(E2历程) 双分子消除反应通常在强碱性试剂存在下发生。当亲核性的碱性试剂B接近β氢时,在B和H间形成微弱键的同时,原有C-H键、C-X键减弱而形成过渡态。而后发生C-B键和C-X键同时断裂构成烯键。
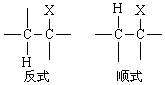
可见E2历程和SN2历程很相似。区别是在于E2历程中碱性试剂进攻β-氢原子;而在SN2历程中反应发生在α-碳原子上。所以在不饱和碳原子上的亲核取代常伴有消除反应发生。 按E2历程进行反应,离去基团的空间排布在理论上有两种,即顺式消除和反式消除。
对于烷基化合物,σ-键可以自由旋转,很难确定按哪种方式进行。 但烯烃衍生物和脂环化合物中,双键和环上的单键自由旋转受到阻碍,就以一种消除方式为主。如1,2-二氯乙烯与碱作用生成氯乙炔的反应。 离去基处于反式位置的异构体比离去基处于顺式位置的易于消除,所以顺式二氯乙烯的反应速度比反式二氯乙烯快20倍。
脂环化合物在进行消除反应时,被消除的两个原子(或基团)处于反式位置易于消除;并且被消除的原子和它们相连的碳原子在同一平面上,反应最易进行。 2.4.1.2 单分子消除反应历程(E1历程) 单分子消除反应历程分两步进行,第一步是离去基解离而形成碳正离子。这步速度较慢是反应的控制步骤。第二步消除β-质子形成烯烃。 当形成碳正离子比较稳定时,反应优先按E1历程进行。
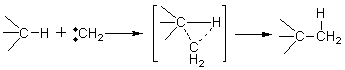
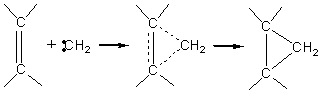
E1和SN1反应常同时发生,两者比值常根据溶剂的极性和温度不同而异。高极性溶剂有利于质子从碳正离子中离去。有利于E1历程的反应。 2.4.2 α-消除反应 α-消除反应是在相同的碳原子上消除两个原子(或基因),形成高度活泼的缺电性质点(卡宾)的反应。卡宾具有特殊的价键状态和化学结构,可以发生多种化学反应。卡宾能与多种单键发生插入反应。
卡宾能与碳-碳双键进行亲电加成反应。
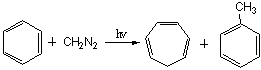
卡宾与芳香族化合物也能发生加成反应,生成环扩大产物,用以合成环烯。
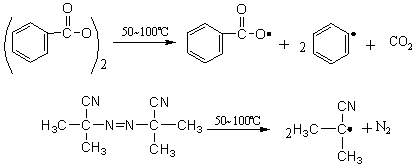
2.4.3 消除反应影响因素 在同样反应条件下,消除反应和亲核取代反应是同时发生的。下列因素将有利于消除反应进行。 2.4.3.1 反应物分子结构的影响 1. 反应物分子的空间效应 被消除原子所连的碳原子上有支链时,如果按双分子反应,在SN2历程反应中亲核试剂进攻β-碳原子,而在E2历程反应中进攻β-氢原子,支链的空间效应对SN2不利,而相对对E2有利;如果按单分子反应,无论是SN1或E1的历程,在反应速度决定步骤中形成同样的碳正离子,只是第二步不同,若连有较多的烷基按E1消除β-氢后,形成双键可减少分子张力,使分子稳定;按SN1取代碳正离子与亲核试剂结合,键角被压缩(由120°减至109.5°),反而张力增加。可见无论按双分子或按单分子反应都对消除反应有利。 2. 反应物分子的电于效应 分子中在β-碳原子上有吸电性基团(X、CN、NO2)增加了β-氢原子的活性,使E2消除反应加速。 3. 离去基团的性质 离去基因吸电子能力增加,使β-氢原子的电子云密度下降,有利于双分子E2消除反应,离去基团对在El历程反应无明显影响。 2.4.3.2 反应条件的影响 1. 碱的影响 试剂的碱性对于双分子反应E2或SN2是有影响的。碱性即是对质子的亲和力,因此试剂碱性增大按E2进行反应更容易。例如,伯仲卤代烷的水解,为了提高醇的收率避免消除反应,大用苛性碱而用乙酸钠作试剂。因为CH3COOˉ的碱性比OHˉ的弱得多,反应按SN2历程进行。 总之,在消除和取代之间,强碱有利于消除不利于取代。而高浓度的强碱在非离子化溶剂中,有利于双分子历程,而且对E2比对SN2更有利。碱的浓度低或没有碱存在时,在离子化溶剂中,有利于单分子历程,而且对SN1比对E1更为有利。 2. 溶剂(介质)的影响 溶剂的极性对反应影响与亲核取代很相似。按单分子反应是先生成碳正离子,而后按E1或SN1历程进行,增加溶剂极性只促进解离中间物的速率,而对E1和SNl产物的比量影响较小。 按双分子反应,在极性小的溶剂中对于形成E2的过渡态条件有利,有利于烯烃生成。 3. 温度的影响 反应无论是单分子还是双分子历程,提高反应温度都有利于消除反应的进行。这可能是消除反应的活化过程需要拉长β-碳氢键的原因。 2.5 游离基反应 游离基反应又称自由基反应,是精细有机合成中一类较重要的反应。它一经引发,通常都能很快进行下去,是快速链锁反应:但反应也能受到某些物质的抑制,这些物质能非常快地与游离基结合,使反应终止。为了使游离基反应能够顺利发生必须先产生一定数量的游离基。常用的方法有三种:热离解法、光离解法和电子转移法。 2.5.1 热离解法 化合物受热到一定温度发生热离解,产生游离基。不同化合物的热离解所需温度不同。例如,氯分子的热离解在100℃以上可具有一定的速度;烃、醇、醚、醛和酮受热到800~1000℃时离解;金属有机化合物所需温度低些,四甲基铅蒸汽通过灼热至600℃的石英管,可离解成甲基游离基。
含有弱键的化合物裂解所需温度低些,例如含有O-O键的过氧化二苯甲酰及偶氮双异丁腈都是常用的引发剂。
2.5.2 光离解法 分子受到光的照射而被活化,活化分子具有较高的能量,它们可以满足化学键均裂所需要的能量。例如,卤素分子用光照射生成它们的原子,光离解可在任何温度下送行,并且能通过调节光的照射强度控制生成游离基的速度。
2.5.3 电子转移法 重金属离子具有得失电子的性能常被用于催化某些过氧化物的分解。例如,亚铁离子将一个电子转移给过氧化氢使它生成一个羟基游离基及一个更稳定的羟基负离子。三价的钴离子可以从过氧化叔丁醇中获取一个电子,使过氧化叔丁醇转变成一个过氧游离基及一个质子。
游离基反应属于连锁反应,其反应历程包括三个阶段,即链的引发、链的传递和链的终止。游离基反应在精细有机合成中有广泛的应用。 2.6 加成反应 加成反应分三种类型,即亲电加成、亲核加成和游离基加成。 2.6.1 亲电加成 亲电加成一般发生在碳-碳双键上,因为烯烃、炔烃分子中的π-电子只有较大的活动性,表现出亲核性,所以它们容易与多种亲电试剂发生亲电加成反应。常用的亲电试剂有:强酸(例如硫酸、氢卤酸)、Lewis酸(例如FeCl3、A1C13、HgC12)、卤素、次卤酸、卤代烷、卡宾、醇、羧酸和酰胺等。其反应历程分两步进行:首先生成碳正离子中间产物,它是速率控制步骤。
然后是:
烯烃的结构不同,对反应速度的影响也完全与上述亲电分步加成历程一致。当碳-碳双键上连有给电性取代基时,由于增加了碳-碳双键上的电子云密度可使碳正离子稳定,因而加快了反应速度。当连有吸电性取代基时,由于降低了碳-碳双键上的电子云密度,降低了碳正离子的稳定性,因而减慢了反应速度。 2.6.2 亲核加成 亲核加成中最重要的是碳氧双键(碳基)的亲核加成。在碳氧双键中氧原子的电负性比碳原子高得多,因此氧原于带有部分负电荷,而碳原子则带有部分正电荷。
碳氧双键在进行加成反应时,带负电荷的氧总是要比带正电荷的碳原子稳定得多,因此在碱性催化剂存在下,总是带正电荷的碳原子与亲核试剂发生反应,即碳氧双键易于发生亲核加成反应。 2.7 重排反应 重排反应是指在试剂作用下或其因素影响下,有机物分子中发生某些基因的转移,形成另一种化合物的反应。重排反应种类很多,只讨论芳香族化合物侧链向环上迁移,以及迁移发生在邻近两个原子间的1,2-迁移。
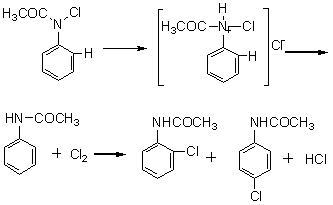
2.7.1 分子间重排 分子间重排反应过程中能够获得分裂出来的迁移基(Z)。例如,在盐酸催化下N-氯乙酰苯胺的重排反应:
首先通过置换生成氯分子,而后氯分子与乙酰苯胺发生亲电取代。 2.7.2 分子内亲电重排 2.7.2.1 联苯胺重排 这是在酸的作用下氢化偶氮苯转化成联苯胺的反应。
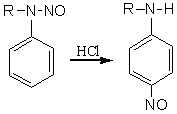
2.7.2.2 N-取代苯胺的重排 N-取代苯胺在酸性条件下迁移基从氮原子迁移到环的邻位或对位上。例如亚硝基的迁移,它是亲电性的重排反应。仲芳胺的N-亚硝基衍生物用盐酸处理时发生重排,主要生成对位异构产物。
2.7.2.3 羟基的迁移 迁移基团作为亲核性质点带着它原先与支链相结合的电子对,从支链迁移至芳环上,这种重排称为芳香族亲核重排。例如,用稀硫酸作用于苯基羟胺,即发生OH-的迁移,生成了氨基酚。
|