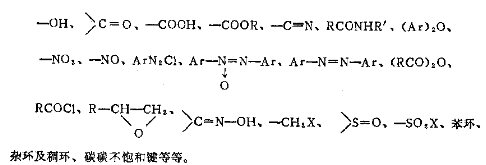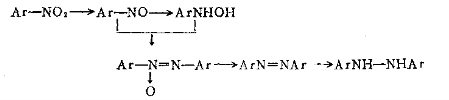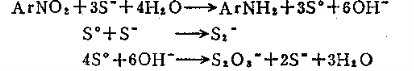|
精细有机化学品的合成与工艺学 第七章 氢化和还原
作者:佚名 转贴自:本站原创 点击数:230
第七章 氢化和还原 7.1 概述 广义地讲,在还原剂的参与下,能使某原子得到电子或电子天密度增加的反应称为还原反应。狭义地讲,即在有机分子中增加氢或减少氧的反应,或者兼而有之的反应称为还原反应。 还原反应在精细有机合成中占有重要的地位。通过还原反应可以制得一系列产物。下列基团在一定条件下被还原:
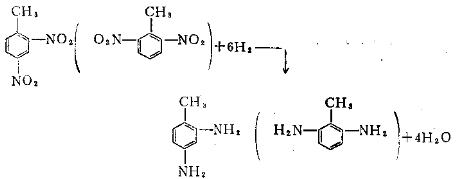
(1)催化氢化法 即在催化剂存在下,有机化合物与氢发生的还原反应称为催化氢化反应。 (2)化学还原法 即使用化学物质作为还原剂的还原方法。化学还原剂的种类繁多,本章重点介绍在工业上常用的几种。化学还原剂包括无机还原剂和有机还原剂。目前使用较多的是无机还原刘。常用的无机还原剂有以下几类:(a)活泼金属及其台免如Fe、Zn、Na、Zn-Hg、Na-Hs等。(b)低价元素的化合物,如Na2S、NaSx、FeCl2、SnCl2、Na2SO4等。(c)金属氢化物,如NaBH4、KBH4、LiAlH4、LiBH4等。常用的有机还原剂有异丙醇铝等烷基铝、甲醛、葡萄糖等。 (3)电解还原法 即有机化合物从电解槽的阴极上获得电子而完成的还原反应。电解还原是一种重要的还原方法。电解还原的发展受到能源、电解槽、电极材料等条件的限制。在国外已有某些产品实现了工业化如丙烯腈用电解还原方法制备已二腈、硝基苯还原制备对-氨基酚、苯胺、联苯胺等。 下面按照还原方法和还原剂的不同进行讨论。 7.2 催化氢化 催化氢化按其反应类型可分为氢化(加氢)反应和氢解反应。氢化是指氢分子加成到烯基、炔基、羰基、氰基、芳环类等不饱和基团上使之成为饱和键的反应,它是π键断裂与氢加成的反应。氢解是指有机化合物分子中某些化学键因加氢而断裂,分解成两部分氢化产物,它是指在反应中σ键断裂并与氢结合的反应。通常容易发生氢解的有碳-卤键、碳-硫键、碳-醚键、氮-氮键、氮-氧键等。本章无特殊需要,不再区分氢化(加氢)和氢解而通称为氢化。 催化氢化按反应的体系可分为:非均相催化氢化(也称为多相催化氢化)和均相催化氢化。前者催化剂自成一相故称它为非均相催化剂,后者催化剂溶解于反应介质中故称它为均相催化剂。均相催化氢化也称为均相络合催化氢化。 催化氢化的优点是反应易于控制,产品纯度较高,收率较高,三废少,在工业上已广泛采用。缺点是反应一般要在加压设备中进行,因此要注意采取必要的安全措施,同时要注意选择适宜的催化剂。在工业生产上目前采用两种不同的工艺:液相氢化法和气相氢化法。多相催化氢化在工业上已得到广泛的应用。 液相氢化是在液相介质中进行的催化氢化。实际上它是气-液-固多相反应。它不受被还原物料沸点的限制,所以适应范围广泛。气相氢化是反应物在气态下进行的催化氢化,实际上它是气-固相反应。它仅适用于易气化的有机化合物,而且在反应温度下反应物和产物均要求要稳定。 由于催化剂的存在,降低了反应的活化能,从而加快了反应速度。利用不同的催化剂和控制不同的反应条件可达到选择性还原的目的。 7.2.1 液相催化氢化 7.2.1.1 催化氢化过程 催化氢化的基本过程是吸附-反应-解吸。影响总的氢化反应速度有如下两方面因素: (1)气-液-固三相之间的传质 其中包括搅拌效率、溶剂粘度、催化剂相对密度、压力等。 (2)化学动力学因素 其中包括催化剂的作用、有机化合物(反应物)结构、反应温度等。 7.2.1.2 催化剂 液相催化氢化使用的催化剂种类很多,通常有几种分类方法: 1. 按金属性质分类 可分为贵金属系和一般金属系。贵金属系大多数属于元素周期表中第Ⅶ族。 以铂、钯为主。近年来也逐步研究了含铑、铱、锇、钌等金属催化剂。一般金属主要是镍、铜等。 2. 按催化剂的创法分类 可分为纯金属粉、骨架型、氢氧化物、氧化物、硫化物等,另外还可以是负载在各种载体上的金属载体型储化剂,其中最重要的是骨架型和载体型。 催化剂是影响加氢还原反应的主要因素。衡量某一催化剂好坏的指标很多,但主要是从催化剂活性、选择性及稳定性这三个方面来评价催化剂的优劣。没有一种催化剂能适合所有氢化还原反应。目前使用较多的有骨架镍及Pd-C。现将这两种类型的催化剂介绍如下: 骨架型:主要是骨架镍,其次是骨架铜、骨架钴。 骨架镍的原料是镍铝合金。随着制备催化剂的温度、镍铝合金的组成、碱的浓度、溶化时间及洗涤条件等方面的不同,所制得的骨架镍催化剂的活性有很大的差异。制成的骨架镍为灰黑色粉末,干燥后在空气中会自燃,因此必需保存在乙醇或蒸馏水中。催化剂长期保存也会变质,制备使用量一般不应超过六个月的量。 催化剂使用后要注意回收套用,不得任意丢弃,因为它仍很活波,干燥后则会燃烧。一般将不再套用的骨架镍倒入无机酸中使其失去活性即可。 由骨架镍催化剂容易中毒,使用寿命短又易自燃,近年来开展了对骨架镍催化剂的改性的研究,如将骨架镍作部分氧化处理使之钝化到不会自燃而又保留足够的活性,制成Ni-Zn型非自燃骨架型镍等。 骨架镍催化剂与贵金属催化剂钯-碳、氧化铂相比,它的氢化温度和压力较高,但价格便宜,制备简便,因此在催化氢化中得到广泛的使用。 载体型:主要是钯-碳催化剂 将钯盐水溶液浸渍在或吸附于载体上(如活性炭),再经还原剂处理,使其形成金属微粒,经洗涤、干燥得载体钯催化剂。它在使用时不需经活化处理,是一类性能优良的催化剂,它作用温和,有较好的选择性,适用于多种有机化合物的选择性氢化还原。钯催化剂是烯烃、炔烃最好的氢化还原的催化剂。它能在室温和较低的氢压下还原很多官能团。它既可在酸性溶液中又可在碱性溶液中起作用(在碱性溶液中活性略有降低)。对毒物的敏感性差,故不易中毒。钯催化剂是一种应用范围较广的催化剂。使用过的钯-碳催化剂要通过处理来套用4~5次,失去活性的钯-碳催化剂要回收处理。 7.2.1.3 影响因素 1. 被氢化物的结构和性质 被氢化物的结构和性质是影响催化氢化反应的重要因素。被氢化物靠近催化剂表面活性中心的难易决定了氢化反应的难易,空间位阻效应大的化合物甚至不能靠近活性中心,所以反应较难进行。为了克服位阻效应对氢化反应的不利影响,要用强化反应条件的方法如提高反应温度和反应压力来完成氢化反应。 2. 催化剂的选择和用量 应根据被氢化物以及反应设备条件选择适宜的催化剂。 催化剂的用量一般较少即可得到满意的结果。其用量为被氢化物质量的10~20%(骨架镍),10%(5%钯-碳), l~2%(PtO2)。催化剂的用量与被氢化物的类型、催化剂的种类、活性及反应条件等多种因素有关。一般在低压氢化时催化剂用量较大。有毒物存在时要适当加大催化剂用量。催化剂的活性高时其用量可适当减少。使用低于正常量的催化剂可提高其选择性。增加催化剂用量可大大加快反应速度,因此在催化氢化中不允许任意加大催化剂用量,以避免氢化反应难以控制。具体应用时要根据实验结果来确定催化剂的最佳用量。这既可以得到最佳的反应结果又可以使反应能安全进行。用过的催化剂均要回收。 3.温度和压力 当催化剂有足够的活性时,再提高反应温度往往会引起副反应的发生,使选择性降低。催化剂的活性和寿命也与温度有关。确定反应温度还应考虑反应物及产物的热稳定性。在达到要求的前提下尽可能选择较低的反应温度。一般情况下,使用铂、钯等催化剂时,大多数氢化反应可在较低的温度和压力下进行。使用骨架镍时,则要求在较高的温度下进行氢化反应。用高活性的骨架镍时,反应温度若超过100℃,会使反应过于激烈,甚至会使反应失去控制。 压力是强化催化氢化的重要手段。氢压增大即氢的浓度增大,因而可加快反应速度。但压力增大使反应的选择性降低。压力超过反应所需要时,会出现副反应,有时会出现危险。 4. 溶剂和介质的酸碱性 溶剂的极性、介质的酸碱性以及溶剂对反应物和氢化产物的溶解度等均能影响反应速度和反应的选择性。这主要是因为溶剂的存在使反应物的吸附特性发生了变化,改变了氢的吸附量。溶剂的存在也会引起催化剂表面状态的改变,可使摧化剂分散得更好,有利于被氢化物、氢、催化剂三者之间的接触。使用不同的溶剂,催化氢化反应速度不同,生成物也会不同。在催化氢化中常用的溶剂有水、甲醇、乙醇、醋酸、乙酸乙酯、四氢呋喃、环己烷、甲基环已烷、苯、二甲基甲酰氨等。 根据采用的溶剂不同大体上分为: (1)无溶剂法 若反应物和生成物在反应温度下都是液体,而且粘度不大时,可不加溶剂氢化反应也能顺利进行。如硝基苯、硝基甲苯、2,4—二硝基甲苯、硝基苯甲醚等的催化氢化可以不用溶剂。但这时需要使用高效的催化剂和有良好的传质条件才可能使反应完成,因此有时还是要加溶剂的。 (2)用水作溶剂 主要用于含有水溶性基团的反应物,如硝基芳磺酸、硝基芳羧酸等。水的质量(如蒸馏水、自来水、深井水)及水介质的pH值也会对氢化反应有影响。 (3)有机溶剂 多数情况下催化氢化要采用有机溶剂。为了避免催化剂中毒必须使用高质量的溶剂。对于氢解反应,最好选用质子性溶剂,特别是含杂原子化合物的氢解时,效果更好。而非质子性溶剂对于芳香烃和烯烃的氢化有利。氢化反应后必须考虑溶剂的回收。对于加氢反应,介质的pH值的改变可以影响催化剂表面对氢的吸附,从而可以改变反应速度。pH值不同还可以影响反应的选样性。一般说来,加氢反应大多在中性介质中进行,而氢解反应则在酸性或碱性介质中进行。例如加碱可以促使碳-卤键氢解,加少量酸可以促使碳-氮、碳-氧键氢解。 5. 搅拌和装料系数的影响 氢化反应为非均相反应,搅拌一方面影响催比剂在反应介质中的分加情况、传质面积,从而影响催化剂能否发挥催化效果,它对能否加速反应有重要作用。另一方面氢化反应是放热反应,良好的搅拌有利于传热,可防止局部过热。同时可以防止副反应的发生和提高选择性。 7.2.1.4 实际操作 1. 氢气来源 在催化氢化时可以使用纯氢及与一氧化碳或其它惰性气体的混合氢。许多大吨位的品种的催化氢化反应大多数采用纯氢做为氢源。工业上提供氢源的主要途径有食盐水电解、天然气转化、水煤气净化以及电解水等。其中以食盐水电解法应用最多。 2. 反应器 反应器是完成催化氢化反应的主要设备,它的结构和材料决定了它所能承受的压力及其使用范围。 常压氢化时,使用的反应器只能适用于常压或稍高于常压的氢化反应。使用这类装置时,一般氢化反应速度较慢,需要使用铂、钯等贵金属催化剂。常压氢化反应器应用范围不广。 中压氢化反应器多数用不锈钢制成或用不锈钢衬套来制备。它应用范围较广,效率较高,有时使用铂、钯等贵金属催化剂,也可采用高活性的骨架镍为催化剂。 高压氢化反应器多为高压釜。它是由厚壁不锈钢制成或用不锈钢衬套制成,它除具有耐高强度外还具有良好的耐腐蚀性能。在使用高压氢化反应器时应特别注意安全,严格遵守有关规定,避免恶性事故的发生。 根据催化剂状态,工业上加氢反应器可以分为: (1)泥浆型反应器 紫有搅拌器的反应锅(间歇与连续)、鼓泡塔及立管式反应器均属于这类反应器,这时使用的粉状催化剂处于悬浮或流动状态。搅拌式加氢釜:一般是加压操作,要安装机械搅拌器,而加氢反应又要求高速搅拌,由于氢的渗透力很强,这给搅拌轴的密封造成了一定的困难。搅拌器的选型和设计是关键性问题,实践证明选用涡轮式搅拌器的效果较好,也有采用所谓复合式搅拌器的,它是由几层搅拌叶构成而每层的搅拌叶形式又不同。对于间歇式小批量的一些精细化工产品,反应器约在50L时。可采用振荡式或摇摆式高压釜进行加氢反应,这时设备的制备和安装可简化。 鼓泡塔式反应器:在中等压力(约几MPa)或较高压力(几十MPa)下进行的催化氢化反应,采用间歇操作的鼓泡塔式反应器较方便。依靠向塔内通入高速的氢气流使塔内的传质良好,因此可以避免轴的密封结构。这样比搅拌式加氢釜容易加工,造价较低,适合于中小规模的生产。塔内进入的氢气量大大超过反应需要量,过量的未反应的氢要循环使用。鼓泡塔底的形式与进气唤头结构对于保持良好的传质及防止固体颗粒沉底有着重要影响。 立管式泥浆型反应器:它属于连续操作的氢化装置,生产能力大。气液固三相并流送入反应器,并从反应系统中连续排出。 (2)固定床反应器 大颗粒的催化剂在设备中处于固定状态。由于加氢催化剂性能的不断提高,使用固定床反应器逐渐增多,按气液两相的流向和分布状态,固定床反应器可分为两种即淋液型及鼓泡型。 (3)流化床反应器 流化床是60年代发展起来的一种新型反应器。采用微球型或挤条型催化剂。气液两相从反应器底部进入反应器,使催化剂在反应过程中在反应器内处于悬浮状态。这种反应器克服了固定床反应器内可能出现的催化剂结焦,以及装卸繁杂等缺点。为了保证催化剂颗粒悬浮以提高传质效率,保证液相有足够的停留时间,常常使液相作循环流动。按照循环方式的不同,又可以分为内循环型和外循环型。 7.2.1.5 实例 1. 芳香族硝基化合物的催化氢化 通常使用钯、铑、铂或骨架镍作催化剂。非芳香族硝基化合物的催化氢化反应不如芳香族硝基化合物快,在进行氢化反应时常常采用加大催化剂用量和强化反应条件如提高反应压为来加速氢化反应的进行。 2,4-二氨基甲苯的制备:它是由2,4-二硝基甲苯通过液相加氢还原而制得的。甲苯经过二硝化得到混合的二硝基甲苯,其中2,4与2,6-异构体的比例是80:20,其反应式及工艺过程如下:
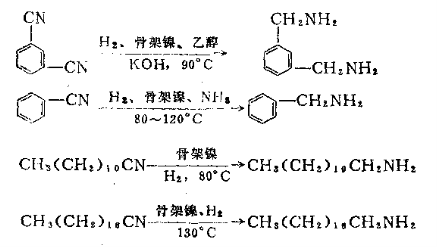
氢化反应采用骨架镍催化剂,甲醇为溶剂。采用立管式泥浆型反应器。含有0.1~0.3%骨架镍的二硝基甲苯的甲醇溶液(1:1),用高压泵连续地送入反应器中,同时通入氢气。每个反应器设有强制外循环管线以强化塔内的传质和传热过程。反应器内温度约100℃左右。压力保持在15~20MPa。从第一塔流出的反比物分别进入并联的第二、第三塔,当物料从最后一个塔流出时,氢化反应已完成。经减压装置后,在气液分离器中分出氢气,在沉降分离器中分出催化剂。分出的氢气及催化剂均要循环使用。得到的粗产品依次脱甲醇、脱水,最后经精榴得到纯度为99%的二氨基甲苯。 2. 腈的还原 腈还原为伯胺是有机合成中引入氨基的重要方法之一。在脂肪族胺类化合物的制备中应用较多。它可以在较温和的条件下进行氢化,在常压时一般用铂、钯催化剂,在加压时用镍催化剂。产物中除伯胺外还得到较多的仲胺。选择适当的条件可以减少仲胺的生成量。例如:
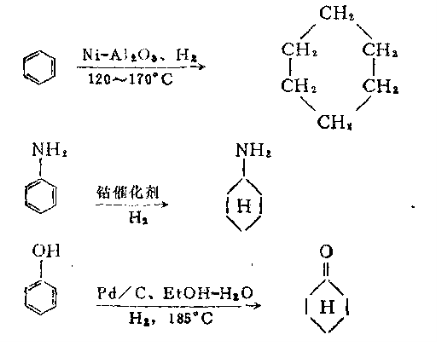
3. 芳环的氢化 苯系芳烃难于氢化,芳稠环如萘、蒽的氢化活性大于苯环,而苯胺、苯酚等取代苯的苯环活性大于苯。通常芳环氢化使用的催化剂为铂、钯、镍。例如:
不饱和键的催化氢化、胺的还原烷基化、羰基的氢化、含硫化合物的氢化及碳氧键的氢解、羰基及酰基的氢解、苄胺及其有关化合物的氢解、脱卤氢解、脱硫氢解、醇的氢解、醚的氢解、肼和腙的氢解等等在行机合成中均有应用。 7.2.2 气相催化氢化 7.2.2.1 催化剂 含铜催化剂是普遍使用的一类,最常使用的是铜-硅胶(Cu-SiO2)载体型催化剂及铜-浮石、Cu-Al2O3。硫化物系催化剂,如NiS、MoS3、WS3、CuS等具有抗中毒能力的催化剂,这是一类有希望的催化剂,例如NiS-Al2O3作为硝基苯加氢制备苯胺的催化剂,苯胺的收率可达到99.5%,催化剂的寿命可达1600h以上。 7.2.2.2 实例
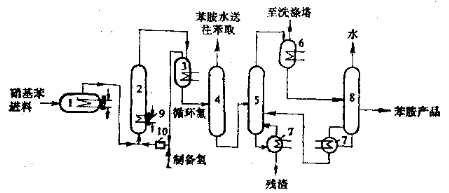
连续流化床硝基苯的气相加氢还原 1-汽化器;2-反应器;3,6-气、液分离器;4-分离器;5-粗馏塔; 7-再沸器;8-精馏塔;9-冷却塔;10-压缩机 采用的是铜-硅胶(Cu-SiO2)载体型催化剂,它的优点是成本低,选择性好,缺点是抗毒性差。在原料硝基苯中有微且的有机硫化物(主要来源于原料焦油苯中的噻吩),极易引起催化剂中毒,所以工业生产上往往使用石油苯为原料生产的硝基苯来制备苯胺。最好在硝基苯进入反应系统前进行一次精馏以确保其质量。由于采用流化床反应器,催化剂在反应中处于激烈的运动状态,所以要求催化剂有足够的耐磨强度。催化剂的颗粒大小对流化质量和有效分离均根重要,一般选用赖粒为0.2~0.3mm较适宜。 7.2.3 催化氢化的安全问题 催化氧化反应中要使用氢气、催化剂,有时还要使用高压容器,这些给安全生产带来了不可忽视的问题,为了保证安全生产应采取必要的措施。 (1)高压设备应置于符合防火、防爆要求的建筑中,要严格按操作规程进行操作。对高压设备要经常检查。 (2)应严禁明火,电器安装、使用要符合防火防爆的有关要求。 (3)催化剂制备、贮存、使用、处理要严格执行各项规定,使用时不得随意加大用量。 (4)不得让氢气、空气与催化剂同时并存。 总之,进行催化氢化反应要按国家有关规定严格执行,这样才可使反应顺利进行又避免出现安全事故。 7.3 在电解质溶液中的铁屑还原 金属铁和酸(例如盐酸、硫酸、醋酸等)共存时,或在盐类电解质(如FeCl2、NH4Cl等)的水溶液中对于硝基是一种强还原刘。它可以将芳香族硝基、脂肪族硝基或其它含氮的基团(例如亚硝基、羟胺基)还原成相应的氨基。在还原反应中一般对被还原物中所含的卤基、烯基、羰基等基团无影响,所以它是一种选择性还原剂。采用在电解质溶液中用铁屑的还原方法是一种古老的方法。铁屑价格低廉,工艺简单,适用范围广,副反应少,对反应设备要求低,因此目前有不少硝基物还原成胺仍采用这种方法。本法的不足之处是有大量的含胶铁泥和含胺废水产生,必需对其进行处理,否则将严重污染环境。随着机械加工行业的技术进步,铁屑的来源也受到了限制,因此产量大的一些胺类(如苯胺)已采用了加氢还原方法,有的芳胺改用硫化碱还原法。 7.3.2 实际操作 7.3.2.1 铁粉还原方法的适用范围 铁粉还原方法的适用范围较广。凡能用各种方法使与铁泥分离的芳胺均可采用铁粉还原方法进行生产。因此,此方法的适用范围在很大程度上并非取决于还原反应本身,而是取决于还原产物的能否分离。分离方法大致有以下几类: (1)对容易随水蒸气蒸出的芳胺,例如苯胺、邻甲苯胺、对甲苯胺、邻氯苯胺、对氯苯胺等,还原反应完毕后,可用水蒸汽蒸馏方法将它们从反应混合物中蒸出。 (2)对易溶于水且可以蒸馏的芳胺,例如间苯二胺、对苯二胺、2,4—二氨基甲苯等,还原反应完成后,可用过滤方法使产物与铁泥分离,然后浓缩母液,再进行真空蒸馏而得到芳胺。 (3)对能溶于热水的芳胺,例如邻苯二胺、邻氨基苯酚、对氨基苯酚等,还原反应完成以后用热过滤法使产物与铁泥分离,滤液冷却,使产物结晶析出。 (4)对含有磺酸基或羧酸基等水溶性基团的芳胺,许多氨基处在萘环 位的萘胺磺酸,可由相应的硝基萘磺酸用铁粉还原法制得,还原后,调成碱性,使氨基萘磺酸溶解,通过过滤除去铁泥,滤液再用酸化或盐析的方法使氨基萘磺酸析出。例如周位酸、劳伦酸就是用铁粉还原法制得的。 (5)对难溶于水而挥发性又很小的芳胺,例如2,4,6一三甲基苯胺可以在还原后用溶剂将产物萃取出来,或用与水互溶的溶剂如乙醇中进行还原,然后乘热滤去碱化的铁泥,再从溶剂中收回芳胺。 (6)多硝基物的部分还原。一般认为铁粉还原法仅适用于硝基的完全还原。近年来发表的文献中报导了二硝基苯衍生物用铁粉还原法在适当的条件下只还原一个硝基。 7.3.2.2 铁粉还原工艺 铁粉还原一般采用间歇操作。由硝基苯用铁粉还原法生产苯胺是个典型的例子,而目前多用加氢法生产苯胺。目前仍有不少芳胺采用铁粉还原方法来生产,如甲苯胺、间苯二胺,某些氯基萘磺酸如周位酸、克立夫酸、H-酸等仍采用本法。 一般在还原锅中加入上批的还原含胺废水、盐酸(有时亦加硫酸)和部分铁屑,生成电解质即完成铁的预蚀。在电解质生成过程中一般要通入直接蒸气加热,然后分批加入被还原物和铁屑,反应开始阶段进行激烈,可靠自身的反应热保持沸腾,反应后期需要通直接蒸气来保持反应物料沸腾一定时间。在反应过程个要用Na2S溶液不断检查有无Fe2+存在,若无Fe2+存在时要补加一定量的酸。反应结束后,加入纯碱、生石灰等使铁离子转变为氢氧化铁沉淀,并使反应液呈弱碱性,再进行其它的后处理,使物料与铁泥分开而得到产物。 7.4 锌粉的还原 锌粉的还原能力与反应介质的酸碱性有关。它在中性、酸性和碱性条件下均具有还原能力。它可以还原硝基、亚硝基、腈基、羰基、碳-碳不饱和键、碳-卤键、碳-硫键等多种官能团。在不同的介质中得到的还原产物也不同。工业上在碱性介质中锌粉还原方法早己使用,主要是生产联苯胺系列的衍生物。 锌粉在碱性条件下进行还原反应,可使硝基化合物发生双分子还原,生成氧化偶氮化合物、偶氮化合物、氢化偶氮化合物。它也可以将酮基还原成羟基或亚甲基。硝基化合物在碱性介质中用锌粉还原的过程为
利用控制反应介质的pH值不同可得到不同的产物。例如硝基苯在中性或弱碱性介质中还原可得到苯基羟胺。若在强碱性介质中如12~13%的NaOH溶液中,反应温度100~105℃时,可生成氧化偶氮苯。若NaOH浓度降到3%时,反应温度90~95℃时,可生成氢化偶氮苯。 氢化偶氮化合物在酸性介质中进行重排,可得到联苯胺系衍生物。
联苯胺是致癌性物质,各国都已相继停止生产,并积极研究代用它的无致癌性中间体,并已取得了一定的进展。对于其它联苯胺系衍生物的毒性问题尚存争议,由于它们在染料、颜料中占有重要地位,且目前尚无代用品种,各生产厂家在加强安全措施的基础上继续生产。 除了锌粉还原法以外,可采用加氢还原法、甲醛法、水合肼法及电化还原法由相应的硝基化合物来制备相应的氢化偶氮化合物。 7.5 含硫化合物还原 含硫化合物包括两大类。一类是硫化物(硫化物、硫氢化物和多硫化物),是较温和的还原剂;另一类是含氧硫化物(亚硫酸盐、亚硫酸氢盐、保险粉)。含硫化合物还原剂主要可将合氮氧的官能团还原成胺基。 7.5.1 硫化物作为还原剂 7.5.1.1 特点及应用范围 所用的硫化物主要有:硫化钠(Na2S)、硫氢化钠(NaHS)硫化铵((NH4)2S)、多硫化钠(Na2Sx,x称为硫指数,等于l~5)。这类还原剂是一类较缓和的还原列,主要用于硝基化合物的还原,特别是当被还原物为多硝基化合物时,它可以选择性地进行部分还原,或是它仅还原硝基偶氨染料中的硝基而不影响偶氮基。 用硫化钠作还原剂时,反应历程为:
还原总反应方程式为:
7.5.1.2 影响因素 1. 被还原物性质 ’ ArNO2中Ar上带有吸电子基时,有利于还原反应的进行,有供电子基时,将阻碍还原反应的进行。例如间二硝基苯还原时,第一个硝基比第二个硝基快1000倍以上。因此可选择适当的条件达到多硝基物的部分还原的目的。 2. 反应介质的碱性 使用不同的硫化物队在反应体系中介质的碱性差别很大。下表给出硫化物在0.1N水溶液中的pH值 各种硫化物在0.1N水溶液中的pH值
Na2S作还原剂时,随着还原反应的进行将不断有NaOH生成,从而使反应介质的pH值不断升高,因而将发生双分子还原,生成氧化偶氮化合物、偶氮化合物、氢化偶氮化合物等副产物。为了避免上述副反应的发生,在反应体系中要加入NH4Cl、MgSO4、MgCl2、NaHCO3等物质来降低介质的碱性。 当使用二硫化钠或多硫化钠时,在反应过程中将没有NaOH产生,可以避免双分子还原副反应的发生。但三硫化钠以上的多硫化钠作为还原剂时,在反应中将有硫析出,使反应产物的分离困难,因此实用价值不大,对于需要控制碱性的还原反应多采用二硫化钠作为还原剂。 7.5.1.3 实际操作 采用硫化碱还原,生产周期短,设备易于密封,对设备腐蚀性小,一般适用于不溶于水的芳胺的制备。不足之处是硫化碱成本较高,产率一般比铁屑法稍低,产生的废液量较大,且还原反应有时需在压力下操作,因此对设备的要求稍高。 1. 多硝基化合物的部分还原 还原剂一般采用Na2S2或NaHS,过量约5~10%,反应温度在40~80℃之间。通常不在沸腾下反应以避免完全还原的发生,有时要加入一些无机盐来控制碱性。以下几种胺类化合物即采用硫化碱还原剂通过部分还原制备。
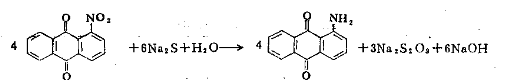
当不对称的间二硝基苯衍生物进行部分还原时,哪个硝基被选择性地还原,一般取决于苯环其它取代基的性质。如果有-OH、-OR等基团存在时,则在其邻位的硝基被还原。 2. 硝基化合物的完全还原 这种还原方法主要用于制备容易和硫代硫酸钠分离的芳胺。还原剂一般采用Na2s或Na2S2,过量约10~20%,反应温度一般在60~100℃,有时可达l50℃左右,提高反应温度可以缩短反应时间,但这时要使用耐压设备。 1-氨基蒽醌的制备:它是合成蒽醌系染料的重要中间体,大家都很重视其合成方法的研究。国内采用蒽醌的硝化还原法来制备。还原采用硫化碱方法。
一般采用过量10~20%的硫化钠溶液,在90~100℃下还原,反应完全后趁热过滤即得纯度为90%左右的粗制品1-氨基蒽醌,通过升华法、硫酸法、保险粉法或精馏法进行精制。 7.5.2 含氧硫化物作为还原剂 这类还原剂中使用较多的为亚硫酸盐、亚硫酸氢盐和连二亚硫酸盐(也称低亚硫酸盐)。亚硫酸钠、亚硫酸氢纳可以将硝基、亚硝基、偶氮基、羟胺还原成氨基,将重氮盐还原成肼。连二亚硫酸钠(Na2S2O4)商品名称为保险粉,它在稀碱介质中是一种强还原剂,使用时条件较温和、反应速度快、产品纯度高,但是它价格高且不易保存,在精细有机合成中很少采用。 7.6 金属氢化物还原剂 金属氢化物还原剂在有机合成上,特别是在精细化工中的应用近期发展十分迅速,其中研究及应用最广的为LiAlH4(铝氢化锂、四氢铝锂)和NaBH4(硼氢化钠、四氢硼钠)。使用这类还原剂还原反应速度快,副反应少,产品产率高,反应条较缓和,选择性好。这类还原剂可使羧酸及其衍生物还原成醇,羰基还原成醇。 各种金属氢化物的还原能力是有差别的。其中LiAlH4是最强的还原剂,用它做还原剂一般均可获得较高的产率,它是一种应用十分广泛的广谱还原剂。LiAlH4是由LiH粉沫与无水AlCl3在干醚中反应制得。
它在水、酸、醇、硫醇等含活泼氢的化合物中发生分解,所以反应不能在上述溶剂中进行。常用无水乙醚、四氢呋喃做为溶剂进行还原反应。 NaBH4是另一种重要的还原剂,它的还原作用较LiAlH4缓和,它仅能使碳基化合物和酰氯还原为醇,不能使硝基还原。它是由氢化钠和硼酸甲酯反应而制得。 在常温时对水、醇等均稳定,所以在还原反应中可用水、醇做溶剂,高温时可选用四氢呋喃、二甲基亚砜等溶剂。 LiAlH4作为还原剂使用具有很多优点,但价格太高,目前仅在实验室中使用。 NaBH4价格稍低,但比其它常用的还原剂仍然贵很多,工业上应用少。这种方法仍值得重视。 7.7 其它还原方法 7.7.1 醇铝还原剂 醇铝也称为烷氧基铝,它是一类重要的有机还原剂,作用缓和,具有高选择性,反应速度快,副反应少,产率高。它仅能使羰基还原成羟基(特殊情况下也可以生成亚甲基),对于碳-碳原于之间的双键、三键、NO2、-Cl等均无还原能力。较常用的还原剂是乙醇铝和异丙醇铝。乙醇铝通过下式合成:
它易于水解,所以在制备和使用时均应在无水条件下进行。使用醇铝进行还原反应是负氢离子的转移过程。在还原羰基化合物时,醇铝中铝原子与羰基的氧原子以配价键形式结合,形成过渡态六元环,然后负氢离子从烷氧基上向碳基转移,铝氧键断裂,最后完成还原过程。 7.7.2 硼烷类
硼烷是亲电试剂,它与羰基上的氧原子相结合,然后硼原子上的氢以负氢离子形式转移到羰基碳原子上,还原成醇。硼烷容易还原羧酸基成相应的醇。当羧酸衍生物中存在有硝基、腈基、氯基、酯基或酮(醛)碳基时,只要控制硼烷的用量和低温反应,可将羧基还原成相应的酸,而其它取代基不受影响,它具有很高的选择性。 硼烷还原脂肪族羧酸的速度大于芳香族羧酸的速度。位阻小的羧酸还原速度大于位阻大的羧酸。 |